广西南宁市“4N”高中联合体2018-2019学年高二下学期化学期末考试试卷
试卷更新日期:2019-09-02 类型:期末考试
一、单选题
-
1. 下列化学用语或模型正确的是( )A、氯化氢的电子式:
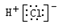 B、乙酸乙酯的分子式为:C4H8O2
C、硫离子结构示意图:
B、乙酸乙酯的分子式为:C4H8O2
C、硫离子结构示意图: 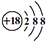 D、乙烯的结构简式:CH2CH2
2. 下列实验操作中,正确的是( )A、把pH试纸浸入待测溶液中,测定溶液的pH B、称NaOH固体质量时,将NaOH固体放在垫有滤纸的托盘上进行称量 C、苯酚沾在皮肤上,应立即用酒精清洗 D、浓硫酸溅在皮肤上,应立即用烧碱溶液冲洗3. 下列说法错误的是( )A、
D、乙烯的结构简式:CH2CH2
2. 下列实验操作中,正确的是( )A、把pH试纸浸入待测溶液中,测定溶液的pH B、称NaOH固体质量时,将NaOH固体放在垫有滤纸的托盘上进行称量 C、苯酚沾在皮肤上,应立即用酒精清洗 D、浓硫酸溅在皮肤上,应立即用烧碱溶液冲洗3. 下列说法错误的是( )A、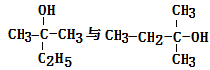 是同一物质
B、
是同一物质
B、 是同分异构体
C、C17H35COOH和CH3COOH是同系物
D、18O2和16O2互为同位素
4. 下列离子方程式书写正确的是( )A、将过量的二氧化碳通入氢氧化钠溶液:CO2+2OH-=CO32-+H2O B、氯化铝溶液中加入过量浓氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O C、氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- D、碳酸钙和醋酸反应:CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑5. A,B,C,D,E五种元素原子序数逐渐增大,且均不超过18,其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是( )A、A与E形成的化合物为离子化合物 B、简单离子半径:E<D C、最高价氧化物对应水化物的碱性:C>D D、气态氢化物的稳定性:B<E6. 下列溶液中一定能大量共存的离子组是( )A、含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- B、pH=1的溶液:Na+、K+、CO32-、SO42- C、含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- D、含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-7. 如图为反应2H2 (g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是( )
是同分异构体
C、C17H35COOH和CH3COOH是同系物
D、18O2和16O2互为同位素
4. 下列离子方程式书写正确的是( )A、将过量的二氧化碳通入氢氧化钠溶液:CO2+2OH-=CO32-+H2O B、氯化铝溶液中加入过量浓氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O C、氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- D、碳酸钙和醋酸反应:CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑5. A,B,C,D,E五种元素原子序数逐渐增大,且均不超过18,其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是( )A、A与E形成的化合物为离子化合物 B、简单离子半径:E<D C、最高价氧化物对应水化物的碱性:C>D D、气态氢化物的稳定性:B<E6. 下列溶液中一定能大量共存的离子组是( )A、含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- B、pH=1的溶液:Na+、K+、CO32-、SO42- C、含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- D、含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-7. 如图为反应2H2 (g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是( ) A、由H、O原子形成2mol H2O(g),共吸收1852 kJ能量 B、拆开2molH2 (g)和1mol O2 (g)中的化学键成为H、O原子,共放出1368kJ能量 C、2molH2 (g)和1molO2 (g)反应生成2mol H2O(g),共放出484 kJ能量 D、2molH2 (g)和1molO2 (g)反应生成2molH2O(l),共吸收484 kJ能量8. 一定温度下,密闭容器中发生反应4A(s)+3B(g) 2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1 , 对此反应速率的表示正确的是( )
A、由H、O原子形成2mol H2O(g),共吸收1852 kJ能量 B、拆开2molH2 (g)和1mol O2 (g)中的化学键成为H、O原子,共放出1368kJ能量 C、2molH2 (g)和1molO2 (g)反应生成2mol H2O(g),共放出484 kJ能量 D、2molH2 (g)和1molO2 (g)反应生成2molH2O(l),共吸收484 kJ能量8. 一定温度下,密闭容器中发生反应4A(s)+3B(g) 2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1 , 对此反应速率的表示正确的是( )
A、用A表示的反应速率是0.4 mol·L-1·min-1 B、2min末的反应速率v(C)=0.3mol·L-1·min-1 C、2min内D的物质的量增加0.2mol D、若起始时A、B的物质的量之比为4:3,则2min末A,B的转化率之比为1:19. 在恒温下使NH2COONH4 (s) 2NH (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )
A、V正(NH3) =2V逆(CO2) B、密闭容器中氨气的体积分数不变 C、密闭容器中总压强不变 D、密闭容器中混合气体的密度不变10. 把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是:①溶液中硫酸的物质的量浓度保持不变;②Cu极上有气泡产生,发生还原反应;③Cu为负极,Zn为正极;④原电池在工作时电子由负极通过溶液流向正极;⑤该装置将化学能转变为电能( )A、②⑤ B、①③⑤ C、②④⑤ D、④⑤11. NaNO2像食盐一样有咸味,有很强的毒性,误食亚硝酸钠(NaNO2)会使人中毒。已知亚硝酸钠能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。下列说法正确的是( )A、该反应的氧化剂为HI B、反应产物中能使淀粉变蓝的物质有I2、NaI C、该反应中每生成1molI2转移2mol电子 D、人误食亚硝酸钠中毒时,可以服用HI溶液解毒12. NA代表阿伏加德罗常数。已知C2H4和C4H8的混合物的质量为ag,下列说法正确的( )A、燃烧时消耗的O2一定是33.6a/14L B、所含碳氢键数目为2aNA/7 C、所含氢原子总数为3aNA/14 D、所含共用电子对数目为3aNA/1413. 下列叙述中,错误的是( )A、甲苯与溴在催化剂FeBr3作用下反应,可生成4种一溴代物 B、C4H10的一氯代物共有4种 C、CH3CH2CH3分子中三个碳原子不在一条直线上 D、C8H10中共有4种属于芳香烃的同分异构体14. 下列实验中,对应的实验现象和实验结论都正确且具有因果关系的是( )选项
实验方法或操作
实验现象
实验结论
A
将小块Na放入CuSO4溶液中
钠浮在水面上四处游动,溶液中有红色沉淀生成
金属Na比Cu活泼
B
在淀粉粉末中加入适量浓硫酸
淀粉变黑
浓硫酸具有吸水性
C
在AlCl3溶液中逐滴滴入NaOH溶液至过量,然后通入CO2气体
先出现白色沉淀,后沉淀消失,最后又出现白色沉淀
Al(OH)3是两性氢氧化物,但不能溶解在某些弱酸中
D
将装满氯水的圆底烧瓶倒置在有氯水的水槽中,日光照射
烧瓶内有气泡向上逸出
日光照射时,溶解的Cl2逸出
A、A B、B C、C D、D15. 已知反应FeO(s)+C(s)=CO(g)+Fe(s)△H>0,(假设△H,△S不随温度变化而变化),下列叙述中正确的是( )A、高温下为自发过程,低温下为非自发过程 B、任何温度下为非自发过程 C、低温下为自发过程,高温下为非自发过程 D、任何温度下为自发过程16. 25℃时,相同物质的量浓度的下列溶液中,c(NH4+)最大的是( )A、(NH4)2SO4 B、(NH4)2Fe(SO4)2 C、NH4HSO4 D、CH3COONH417. 能说明醋酸是弱电解质的是( )A、中和10mL 1mol/L CH3COOH溶液需要10mL 1mol/L NaOH溶液 B、用食醋可以除热水瓶内的水垢 C、用浓H2SO4和醋酸钠固体共热可制得醋酸 D、pH=2的醋酸溶液稀释1000倍后pH小于518. MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是( )A、c(M+)>c(OH-)>c(A-)>c(H+) B、c(M+)>c(A-)>c(OH-)>c(H+) C、c(M+)>c(A-)>c(H+)>c(OH-) D、c(M+)>c(H+)>c(A-)>c(OH-)二、推断题
-
19. 下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族
周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
2
⑥
⑦
⑧
3
①
③
⑤
⑨
⑩
4
②
④
(1)、在③~⑦元素中,原子半径最大的是(填元素符号);(2)、⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有;(3)、写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:。(4)、③、⑤、⑦、⑧所形成的离子,其半径由小到大的顺序是(填离子符号)(5)、①~⑨中元素最高价氧化物对应的水化物中酸性最强的是(填物质化学式),呈两性的氢氧化物是(填物质化学式);该化合物与NaOH溶液反应的离子方程式为。(6)、用电子式表示元素③与⑨形成化合物的过程。(7)、写出工业冶炼⑤的化学方程式:。20. 工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。(1)、NOx和SO2在空气中存在下列平衡:2NO(g)+ O2(g) 2NO2(g) △H= -112 kJ·mol-1
2SO2(g)+ O2 (g) 2SO3(g) △H= -196 kJ·mol-1
SO2通常被NO2进一步氧化,生成SO3和一种无色有毒的气体。请写出NO2和SO2反应的热化学方程式。
(2)、常温下,烟气中SO2被NaOH溶液吸收可得到NaHSO3、Na2SO3等。①已知Na2SO3水溶液显碱性,原因是(写出主要反应的离子方程式),该溶液中c(Na+)2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②常温下,0.1mol/L的NaHSO3溶液的pH=6,则c(SO32-)—c(H2SO3)=mol/L(填写准确数值)。
21. [选修5——有机化学基础] 合成纤维中目前产量占第一位的是聚酯纤维——涤纶。涤纶是聚对苯二甲酸乙二醇酯的商品名,其结构为:
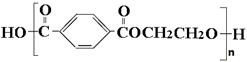
涤纶的一种合成路线如下:
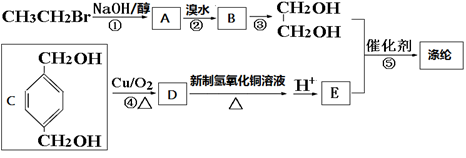 (1)、A中官能团的结构式为 , 反应①、②的反应类型分别为、 , 有机物B的名称是 , 反应③可用的试剂为。(2)、写出反应⑤的化学方程式:。(3)、写出有机物C的同分异构体中,含有苯环,并同时符合下列条件的所有有机物的结构简式:。
(1)、A中官能团的结构式为 , 反应①、②的反应类型分别为、 , 有机物B的名称是 , 反应③可用的试剂为。(2)、写出反应⑤的化学方程式:。(3)、写出有机物C的同分异构体中,含有苯环,并同时符合下列条件的所有有机物的结构简式:。a能发生消去反应 b能与浓溴水反应生成白色沉淀 c核磁共振氢谱有6个峰
(4)、工业上常用烃F直接氧化来制取有机物E。已知:F的分子式为C8H10 , 则其结构简式为;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构有种。三、综合题
-
22. 甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。有人模拟用CO和H2合成甲醇,其反应为:CO(g) + 2H2(g) ⇌ CH3OH(g) △H<0(1)、在容积固定为1L的密闭容器内充入2 mol CO和4 mol H2发生上述反应,20min时用压力计监测容器内压强的变化如下:
反应时间/min
0
5
10
15
20
25
压强/MPa
12.4
10.2
8.4
7.0
6.2
6.2
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=mol/(L·min),该温度下平衡常数K= , 若平衡后增大压强,则K值(填“增大”、“减小”或“不变”)。
(2)、在恒温恒容的密闭容器中,不能判定CO(g)+2H2(g) ⇌CH3OH(g) △H<0,反应达到平衡的是___________;A、压强保持不变 B、气体的密度保持不变 C、气体平均摩尔质量保持不变 D、速率v(H2):v(CH3OH)=2:1(3)、如图是甲醇燃料电池结构示意图,C是(填“正”或“负”)极,写出此电极的电极反应式。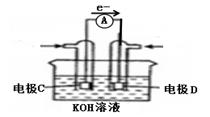 (4)、若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为mol/L。23. [选修3——物质结构与性质] 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。(1)、在Y的最高价氧化物分子中,Y原子轨道的杂化类型是。(2)、Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是;Z的氢化物在固态时的密度比在液态时还小,其原因是;(3)、Y与Z可形成YZ42-。
(4)、若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为mol/L。23. [选修3——物质结构与性质] 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。(1)、在Y的最高价氧化物分子中,Y原子轨道的杂化类型是。(2)、Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是;Z的氢化物在固态时的密度比在液态时还小,其原因是;(3)、Y与Z可形成YZ42-。①YZ42-的空间构型为(用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式:。
(4)、X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2 , 1 mol该配合物中含有σ键的数目为。
(5)、X与Y所形成化合物晶体的晶胞如图所: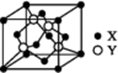
①在该晶体中,X离子的配位数为 , 与Y距离最近且距离相等的Y原子的数目为。
②该晶胞的边长为a cm,该晶体的密度为 g·cm-3。