专题7:铁及其化合物
试卷更新日期:2019-08-30 类型:一轮复习
一、单选题
-
1. 下列有关铁及其化合物的说法中正确的是( )A、赤铁矿的主要成分是Fe3O4 B、铁与水蒸气在高温下的反应产物为Fe2O3和H2 C、除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 D、Fe3+与KSCN溶液产生红色沉淀2. 下列说法错误的是( )A、钠在空气燃烧时先熔化,再燃烧,最后所得的产物是Na2O2 B、铝因在空气中形成了一薄层致密的氧化膜,保护内层金属,故铝不需特殊保护 C、铁因在潮湿的空气中形成的氧化物薄膜疏松,不能保护内层金属 D、SiO2是酸性氧化物,不与任何酸发生反应3. 下列变化不能通过一步反应直接完成的是( )A、Fe→Fe3+ B、Fe→Fe3O4 C、Al(OH)3→Al2O3 D、Al→Al(OH)34. 一定条件下A、B、C的如图所示的转化关系,且△H=△H1+△H2 . 则A、C可能是( )

①Fe、FeCl3
②C、CO2
③AlCl3、NaAlO2
④NaOH、NaHCO3
⑤S、SO3
⑥Na2CO3、CO2 .
A、②③④⑥ B、②③④⑤⑥ C、①②③④⑥ D、①②③④⑤⑥5. 一定条件下,下列各组物质能一步实现如图所示转化关系的是( )选项
X
Y
Z
W
A
Al
Al2O3
NaAlO2
Al(OH)3
B
Fe2O3
Fe
FeCl2
FeCl3
C
H2SO4
SO2
S
SO3
D
NH3
N2
NO
NO2
 A、A B、B C、C D、D6. 常温下,将一定量的铁粉加入到50 mL10mol/L硝酸(①)中,待其充分反应后,收集到的气体换算成标准状况下的体积为4.2L(②),所得溶液能够使淀粉碘化钾溶液变蓝(③),该溶液也能使酸性高锰酸钾褪色(④)。下列说法正确的是( )A、①中数据表明,硝酸是浓硝酸,因此Fe已经钝化 B、②中数据表明,生成的气体中只有NO2 C、③中现象表明,硝酸一定有剩余 D、④中现象表明,溶液中一定含有Fe2+7. FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断正确的是( )A、溶液中一定含Cu2+ B、溶液中不一定含Fe2+ C、剩余固体一定含Cu和Fe D、加入KSCN溶液一定不变红色8. 铜片和铁片(均少部分被氧化)一起放入足量的盐酸中充分反应。反应后的溶液中( )A、一定有Fe3+ B、一定有Fe2+ C、一定有Cu2+ D、一定没有Cu2+9. 某同学分别向FeCl3溶液加入以下试剂验证Fe3+的性质,其中不能达到目的的是( )A、KSCN溶液 B、AgNO3溶液 C、NaOH溶液 D、铁钉10. 金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化关系中不能通过一步反应完成的是( )A、Na→NaOH→Na2CO3→NaCl B、Fe→Fe(NO3)3→Fe(OH)3→Fe2O3 C、Mg→MgCl2→Mg(OH)2→MgSO4 D、Al-Al2O3→Al(OH)2→AlCl3
A、A B、B C、C D、D6. 常温下,将一定量的铁粉加入到50 mL10mol/L硝酸(①)中,待其充分反应后,收集到的气体换算成标准状况下的体积为4.2L(②),所得溶液能够使淀粉碘化钾溶液变蓝(③),该溶液也能使酸性高锰酸钾褪色(④)。下列说法正确的是( )A、①中数据表明,硝酸是浓硝酸,因此Fe已经钝化 B、②中数据表明,生成的气体中只有NO2 C、③中现象表明,硝酸一定有剩余 D、④中现象表明,溶液中一定含有Fe2+7. FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断正确的是( )A、溶液中一定含Cu2+ B、溶液中不一定含Fe2+ C、剩余固体一定含Cu和Fe D、加入KSCN溶液一定不变红色8. 铜片和铁片(均少部分被氧化)一起放入足量的盐酸中充分反应。反应后的溶液中( )A、一定有Fe3+ B、一定有Fe2+ C、一定有Cu2+ D、一定没有Cu2+9. 某同学分别向FeCl3溶液加入以下试剂验证Fe3+的性质,其中不能达到目的的是( )A、KSCN溶液 B、AgNO3溶液 C、NaOH溶液 D、铁钉10. 金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化关系中不能通过一步反应完成的是( )A、Na→NaOH→Na2CO3→NaCl B、Fe→Fe(NO3)3→Fe(OH)3→Fe2O3 C、Mg→MgCl2→Mg(OH)2→MgSO4 D、Al-Al2O3→Al(OH)2→AlCl3二、填空题
-
11. 往氯化亚铁溶液中滴加氢氧化钠溶液,现象是
往氯化铁溶液中滴加氢氧化钠溶液,现象是
往氯化铁溶液中滴加硫氰化钾溶液,现象是
往氯化铝溶液中滴加氢氧化钠溶液至过量,现象是 .
12. 将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应(假定容器不参与反应).试判断下列情况下,溶液中存在的金属离子和金属单质.(1)、若铁粉有剩余,则容器中不可能有的离子是 , 铜单质(填“一定”或“可能”)存在.(2)、若CuCl2有剩余,则容器中还可能有的离子为 , 铜单质(填“一定”或“可能”)存在.(3)、若FeCl3和CuCl2都有剩余,则容器中不可能有的单质是 , Fe2+(填“一定”或“可能”)存在.三、综合题
-
13. 如图,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的水蒸气,并靠近火焰点燃。
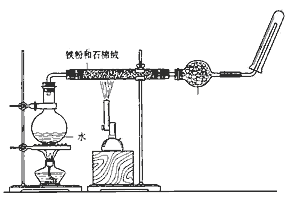 (1)、写出该反应的化学方程式 , 氧化剂是。(2)、加热烧瓶的作用是 , 烧瓶底部放了几片碎瓷片,其作用是。干燥管里可装入的试剂是 , 其作用是。(3)、实验开始时应先点燃(填“酒精灯”或“酒精喷灯”)。14. 铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示:
(1)、写出该反应的化学方程式 , 氧化剂是。(2)、加热烧瓶的作用是 , 烧瓶底部放了几片碎瓷片,其作用是。干燥管里可装入的试剂是 , 其作用是。(3)、实验开始时应先点燃(填“酒精灯”或“酒精喷灯”)。14. 铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示:I.回答下列有关问题:
(1)、向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是nm。(2)、电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2 , 制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:。检验反应后溶液中还存在Fe3+的试剂是。(3)、在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是.(4)、II.现有五种溶液,分别含下列离子:①Ag+ , ②Mg2+ , ③Fe2+ , ④Al3+ , ⑤Fe3+。写出符合下列条件的离子符号:既能被氧化又能被还原的离子是 , 加铁粉后溶液增重的是 (填写离子符号)
(5)、向Fe2+的溶液中滴加NaOH溶液,现象是 。(6)、欲除去FeCl2中FeCl3选用的试剂是 , 并写出相应离子方程式:。15.(1)、(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,用离子方程式解释其目的。
(2)、甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为。(3)、乙组同学认为甲组的实验不够严谨,请你代表乙组发表改进方案。(4)、(二)工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下: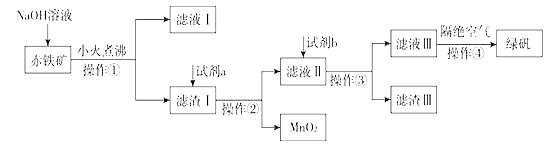
氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为。
(5)、向滤渣Ⅰ中加入过量的试剂a为 , 加入过量试剂b后所得滤渣Ⅲ的主要成分为。(6)、操作③需要的玻璃仪器主要包括。(7)、操作④需要隔绝空气的主要原因可能是什么?。16. 框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
请问答下列问题:
(1)、反应①-⑤中,既属于氧化还原反应又属于化合反应的是(填序号)。(2)、反应⑤的化学方程式为。(3)、甲与B反应的离子方程式 。(4)、在实验室将C溶液滴入F溶液中,观察到的现象是(5)、在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:。17. 某研究性学习小组请你参与“研究铁与水反应利用”实验,并检验产物的性质: (1)、B中与水蒸气发生反应的化学方程式为 .(2)、D中碱石灰的作用是 .(3)、E中实验现象是 .(4)、上述实验结束后,取出B中铁粉反应后的少量固体继续进行如下实验:
(1)、B中与水蒸气发生反应的化学方程式为 .(2)、D中碱石灰的作用是 .(3)、E中实验现象是 .(4)、上述实验结束后,取出B中铁粉反应后的少量固体继续进行如下实验:
①B中产物与稀硫酸发生的离子方程式为:。
②试剂A是(选填字母)。
a.NaOH溶液 b酸性KMnO4溶液 c.酚酞 d.氯水
③若用电子天平称取铁粉质量为0.1527g,测得生成氢气体积为73.50mL(实验室条件下气体摩尔体积为24.5L/mol).则参加反应的铁粉占称取铁粉的百分数为(精确到0.1%)。
④有同学认为:即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是。
四、真题演练
-
18. (14分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途.某化学兴趣小组对绿矾的一些性质进行探究.回答下列问题:(1)、在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化.再向试管中通入空气,溶液逐渐变红.由此可知:、 .(2)、
为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验.
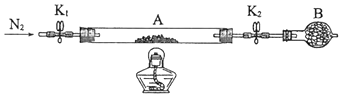
①仪器B的名称是 .
②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g.
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2e.称量Af.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示).若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”).
(3)、为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热.实验后反应管中残留固体为红色粉末.
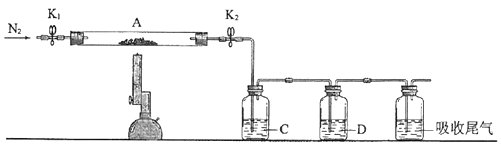
①C、D中的溶液依次为(填标号).C、D中有气泡冒出,并可观察到的现象分别为 .
a.品红b.NaOHc.BaCl2d.Ba(NO3)2e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式 .