专题6:物质的量及相关推论
试卷更新日期:2019-08-30 类型:一轮复习
一、单选题
-
1. 用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )A、a g C2H4和C3H6的混合物所含原子总数为
 B、常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA
C、标准状况下,22.4 L H2O含有的分子数为 NA
D、物质的量浓度为0.5 mol·L−1的MgCl2溶液中,含有Cl−个数为NA
2. 下列各组物质中,所含分子数目不相同的是( )。A、同温同压下,相同体积的N2和H2 B、10 g H2和10 g O2 C、9 g H2O和0.5 mol Br2 D、22 g CO2和3.01×1023个N23. 同温同压下的不同气体其体积可能不相同,其主要原因是( )A、粒子大小不同 B、粒子质量不同 C、粒子间距离不同 D、粒子数目不同4. 下列物质所含原子个数由多至少的顺序是( )
B、常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA
C、标准状况下,22.4 L H2O含有的分子数为 NA
D、物质的量浓度为0.5 mol·L−1的MgCl2溶液中,含有Cl−个数为NA
2. 下列各组物质中,所含分子数目不相同的是( )。A、同温同压下,相同体积的N2和H2 B、10 g H2和10 g O2 C、9 g H2O和0.5 mol Br2 D、22 g CO2和3.01×1023个N23. 同温同压下的不同气体其体积可能不相同,其主要原因是( )A、粒子大小不同 B、粒子质量不同 C、粒子间距离不同 D、粒子数目不同4. 下列物质所含原子个数由多至少的顺序是( )①0.5 mol氨气 ②4g氦气 ③4℃时9mL水 ④0.2mol磷酸钠
A、①④③② B、④③②① C、②③④① D、①④②③5. 同温同压下有两份体积相同的CO2和O3 , 关于它们的叙述正确的是( )A、分子数之比是1∶1 B、原子个数比是3∶2 C、质量比是 1∶1 D、密度之比是1∶16. 下列关于物质的量浓度表述正确的是( )A、98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L B、当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1mol•L-1 , 只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1mol•L-1 C、只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 D、50mL 1mol/L的AlCl3溶液中的Cl—浓度与50mL 3mol/L的BaCl2溶液Cl—浓度相等7. 将硫酸铝、硫酸钾、明矾三种物质组成的混合物溶于水,所得溶液中SO42-的浓度为0.20mol/L。向其中加入等体积0.20mol/L的KOH溶液(混合后溶液体积变化忽略不计),生成的白色沉淀质量恰好达到最大值,此时混合溶液中K+的浓度是 ( )A、0.40mol/L B、0.1mol/L C、0.225mol/L D、0.20mol/L8. 现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的物质的量之比为( )A、1:1:1 B、1:2:3 C、3:2:1 D、6:3:29. 某气体的摩尔质量为M g/mol,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为X。则 表示的是( )A、V L该气体的质量(以g为单位) B、1 L该气体的质量(以g为单位) C、1 mol该气体的体积(以L为单位) D、1 L该气体的物质的量(以mol为单位)10. 用20 mL 18.4 mol/L的浓H2SO4与铜共热一段时间后,冷却,过滤除去多余的铜,将滤液加水稀释到100 mL,所得溶液中SO2的浓度为3.18 mol/L,则此时溶液中CuSO4的物质的量浓度为( )
A、0.50 mol/L B、0.75 mol/L C、1.00 mol/L D、3.18 mol/L11. 下图是实验室硫酸试剂标签上的部分内容,据此下列说法正确的是( ) A、配制500mL4.6 mol/L的稀硫酸需取该硫酸125mL B、1molAl与足量的该硫酸反应产生3g氢气 C、该硫酸的物质的量浓度为9.2mol/L D、将该硫酸加水配成质量分数49%的溶液时其物质的量浓度等于9.2mol/L12. 向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系错误的是( )A、 B、 C、n=m+17Vc D、 m<p<13. 向含H2S、Fe2+、Br-、I-各0.1 mol的溶液中通入Cl2 , 通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是( )A、
A、配制500mL4.6 mol/L的稀硫酸需取该硫酸125mL B、1molAl与足量的该硫酸反应产生3g氢气 C、该硫酸的物质的量浓度为9.2mol/L D、将该硫酸加水配成质量分数49%的溶液时其物质的量浓度等于9.2mol/L12. 向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系错误的是( )A、 B、 C、n=m+17Vc D、 m<p<13. 向含H2S、Fe2+、Br-、I-各0.1 mol的溶液中通入Cl2 , 通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是( )A、 B、
B、 C、
C、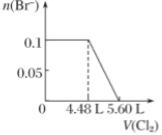 D、
D、 14. 25℃和101kPa时,甲烷、乙烯和乙炔组成的混合烃32mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了52mL,原混合烃中乙炔的体积分数为( )A、12.5% B、25% C、50% D、75%15. 某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的( )
14. 25℃和101kPa时,甲烷、乙烯和乙炔组成的混合烃32mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了52mL,原混合烃中乙炔的体积分数为( )A、12.5% B、25% C、50% D、75%15. 某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的( )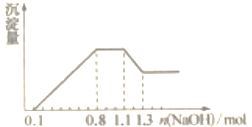 A、溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+ B、溶液中一定不含CO32-和NO3- , 一定含有SO42- C、溶液中c(NH4+)=0.3mol·L-1 D、c(H+):c(Al3+):c(Mg2+)=1:1:116. 下列有关说法中不正确的是(不考虑盐的水解)( )A、同质量,不同密度的N2和CO所含原子数目相等 B、标准状况下,1LO2含p个分子,则NA=22.4pmol-1 C、VLAl2(SO4)3溶液中含amol Al3+ , 则c(SO42-)= mol·L-1 D、氦气的摩尔质量为Mg·mol-1 , 则一个氨原子的质量为 g
A、溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+ B、溶液中一定不含CO32-和NO3- , 一定含有SO42- C、溶液中c(NH4+)=0.3mol·L-1 D、c(H+):c(Al3+):c(Mg2+)=1:1:116. 下列有关说法中不正确的是(不考虑盐的水解)( )A、同质量,不同密度的N2和CO所含原子数目相等 B、标准状况下,1LO2含p个分子,则NA=22.4pmol-1 C、VLAl2(SO4)3溶液中含amol Al3+ , 则c(SO42-)= mol·L-1 D、氦气的摩尔质量为Mg·mol-1 , 则一个氨原子的质量为 g二、填空题
-
17. 若agCO含b个分子,则阿伏加德罗常数的值为 mol﹣1 .18. 下面是中学化学实验中常见的几种仪器:
A.量筒 B.容量瓶 C.试管 D.圆底烧瓶 E.托盘天平
①其中仪器上要标出使用温度的是(填选项)
②可用作反应容器并能进行加热的是(填选项)
③下列操作,使得实验结果偏小的是(填选项)
A.称取5.2gNaCl固体时,将砝码放在左盘,NaCl固体放在右盘
B.配制一定物质的量浓度的NaCl溶液,转移NaCl溶液前,容量瓶中已有少许蒸馏水
C.配制一定物质的量浓度的NaCl溶液,定容时俯视读数.
D.用量筒量取一定体积的浓硫酸,浓硫酸倒入烧杯后,用蒸馏水继续冲洗量筒内壁并将洗涤液倒入烧杯.
三、综合题
-
19.(1)、在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是。(2)、A、B两种气体组成的混合气体8.6 g,在标准状况下体积为8.96 L。已知A与B的物质的量之比为3∶1,相对分子质量之比为14∶1,由此可推断A可能是 , B可能是。(3)、在标准状况下,CO和CO2的混合气体质量为36 g,体积为22.4 L,则CO所占的体积是L,质量是 g。20. 将Cu2O与Fe2O3的混合物共ag加入20.0mL4.00mol·L-1的过量稀硫酸中,充分反应后剩余固体的质量为bg。请计算:(1)、若向反应后的溶液中加入40.0mLNaOH溶液能刚好使溶液中的所有金属离子完全沉淀,则该氢氧化钠溶液的物质的量浓度为mol·L-1。(2)、若a=7b,则混合物中Cu2O与Fe2O3的物质的量之比为。21. 碘和铁均是人体必需的微量元素。(1)、海带中含有丰富的以碘离子形式存在的碘元素。在实验室中,从海藻中提取碘的流程如下:
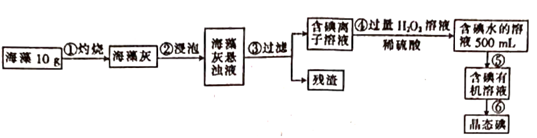
①上述流程中涉及下列操作,其中错误的是(填标号)

②写出步骤④发生反应的离子方程式: 。
③要证明步骤④所得溶液中含有碘单质,可加入(填试剂名称),观察到 (填现象)说明溶液中存在碘。
(2)、探究铁与稀硝酸的反应。用5.6gFe粉和含有0.3 mol HNO3的稀硝酸进行实验,若两种物质恰好完全反应,且HNO3只被还原成NO。回答下列问题:①Fe粉与稀硝酸反应生成硝酸铁的化学方程式为 。
②反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+):n(Fe2+)=。
③标准状况下,生成NO气体的体积为 L(保留两位小数)。
四、真题演练