专题5:氯及其化合物、卤素
试卷更新日期:2019-08-30 类型:一轮复习
一、单选题
-
1. 为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须( )A、除去铁锈 B、用盐酸清洗 C、彻底干燥 D、加点铁粉2. 下列物质不能作为漂白剂的是()A、SO2 B、Ca(ClO)2 C、稀盐酸 D、新制氯水3. 对Cl2的叙述正确的是( )A、能用钢瓶贮存 B、与过量的Fe反应只生成FeCl2 C、与H2混合光照可制取HCl D、与澄清石灰水反应制取漂粉精4. 下列关于F、Cl、Br、I性质的比较,不正确的是( )A、单质的颜色随核电荷数的增加而加深 B、单质的熔、沸点随核电荷数的增加而升高 C、单质的氧化性减弱 D、它们的氢化物的稳定性随核电荷数的增加而增强5. 下列有关颜色变化的叙述不正确的是 ( )A、淀粉溶液中滴入碘水﹣﹣变蓝色 B、溴化银见光分解﹣﹣变黑色 C、苯酚溶液中滴入Fe 3+﹣﹣变紫色 D、胆矾空气中久置﹣﹣变白色6. 向含有NaBr、NaI的溶液中通入过量的Cl2 , 然后将溶液蒸干,并灼烧固体,最后得到的物质是( )A、NaCl B、NaCl和NaBr C、NaCl和NaI D、NaCl和I27. 下列关于碱金属、卤素的描述正确的是( )A、碱金属在空气中加热均可生成多种氧化物 B、碱金属与水反应,均浮在水面上. C、卤素各单质都能和水剧烈反应. D、卤素单质越活泼,其熔沸点就越低8. 实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
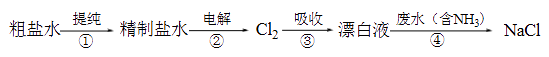
下列分析正确的是( )
A、①中采用蒸馏的方法精制粗盐水 B、②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑ C、③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO D、②、③、④中均发生了氧化还原反应9. 证明某白色固体中含有Cl﹣的正确操作方法是( )A、加入AgNO3溶液和稀硝酸,看是否有白色沉淀生成 B、溶于水后加入AgNO3溶液,看是否有白色沉淀生成 C、加入AgNO3溶液,看是否有白色沉淀生成 D、溶于水后先加入Ba(NO3)2溶液,再加入AgNO3溶液和稀硝酸,看是否有白色沉淀生成10. 实验室制备氯气的装置如下图。图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是( )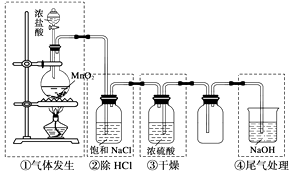 A、① B、② C、③ D、④
A、① B、② C、③ D、④二、填空题
-
11. 1)一种变色眼镜的镜片和普通照相感光胶片中含有卤化银.镜片变化是因为卤化银在光的作用下发生化学反应,其反应式是 ,照相感光胶片曝光的化学反应是 .
(2)在我国干旱严重的华北地区,近年来利用飞机、高炮或火箭等运载工具向过冷支层中播撒碘化银(AgI)或干冰,实现人工增雨(或人工增雪),达到减灾的目的.下列有关人工增雨的评述中,你认为不甚理智的是 .
A.它对农业生产条件和大气环境的改善有一定的效益
B.它使用的碘化银中的重金属元素对土壤造成污染
C.它使用的AgI如换成干冰,可避免重金属元素对土壤的污染
D.它是人类彻底战胜自然的表现,体现了人类的力量是无穷的.
12. 溴有“海洋元素”之称,海水中溴含量为65mg·L-1 , 实验室模拟海水中溴的提取。实验方法:将适量新制氯水加入到20mL富含溴离子的海水中(海水可以用01mol·L-1的溴化钠溶液代替),把溴置换出来
(1)、氯水中的氯气作 剂,涉及反应的离子方程式为 .(2)、得到的单质溴可以用有机溶剂在 (仪器)中实现萃取富集。13. 某同学按如图进行实验,在A中放的是干燥的红色布条,在B中放的是湿润的红色布条,在C中盛放的是氢氧化钠溶液,回答下列问题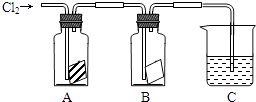
A中现象是 B中现象是
结论是
③若C中盛有的是混有酚酞溶液的氢氧化钠溶液,当通入一定量的氯气时溶液红色褪去,有同学说红色消失的原因有两种可能,请你帮他写出哪两种可能?
a:
b:
请设计实验证明哪种可能正确 .
三、实验探究题
-
14. 在实验室中用二氧化锰和浓盐酸反应制备纯净干燥的氯气,装置图如图所示。制备氯气的反应方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
 (1)、C中装有的试剂是 。(2)、D中所盛试剂是浓硫酸,作用是。(3)、E用的是排空气法收集气体(填“向上”或“向下”)。(4)、F中盛放的试剂是NaOH溶液,用于吸收多余的氯气,反应的离子方程式为。(5)、在上述反应中,每消耗0.4molHCl,生成的Cl2的质量为。15. 氯气是黄绿色有强烈刺激性气味的剧毒气体,是重要的工业原料。回答下列问题(1)、将钠切去氧化层并用滤纸吸干煤油,在石棉网上微热至熔化后,立即用盛满氯气的集气瓶倒扣在其上方。现象是 ,该反应中反应物的能量 (填“高于”或“低于”)生成物的能量。(2)、向盛有KI溶液的试管中加入少许CCl4后滴加新制的氯水,振荡后静置,CCl4层变成紫红色,用离子方程式解释: .(3)、光照下Cl2可与CH4反应,写出生成一氯甲烷的化学方程式: 。实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
(1)、C中装有的试剂是 。(2)、D中所盛试剂是浓硫酸,作用是。(3)、E用的是排空气法收集气体(填“向上”或“向下”)。(4)、F中盛放的试剂是NaOH溶液,用于吸收多余的氯气,反应的离子方程式为。(5)、在上述反应中,每消耗0.4molHCl,生成的Cl2的质量为。15. 氯气是黄绿色有强烈刺激性气味的剧毒气体,是重要的工业原料。回答下列问题(1)、将钠切去氧化层并用滤纸吸干煤油,在石棉网上微热至熔化后,立即用盛满氯气的集气瓶倒扣在其上方。现象是 ,该反应中反应物的能量 (填“高于”或“低于”)生成物的能量。(2)、向盛有KI溶液的试管中加入少许CCl4后滴加新制的氯水,振荡后静置,CCl4层变成紫红色,用离子方程式解释: .(3)、光照下Cl2可与CH4反应,写出生成一氯甲烷的化学方程式: 。实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。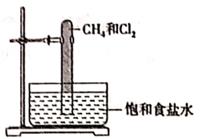
光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是(填标号)
A.
 B.
B. 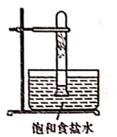 C.
C. 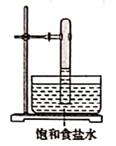 D.
D. 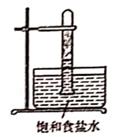 16. CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并验证其它分解产物。
16. CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并验证其它分解产物。(查阅资料)
①

②CuCl是一种白色难溶固体,潮湿CuCl在空气中缓慢被氧化
(1)、配平潮湿CuCl在空气中被氧化的化学方程式:CuCl+O2+ =3CuO·CuCl2·3H2O+HCl
(2)、(实验探究)该小组选用下图装置进行实验(夹持加热仪器略)。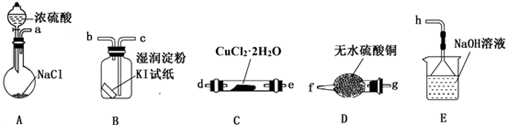
装置A用于制取HCl:NaCl+H2SO4=NaHSO4+HCl↑,浓硫酸在该反应中体现强酸性和性;
(3)、按实验要求选择上图装置,连接顺序为:a(按气流方向,用小写字母表示);(4)、根据完整的实验装置进行实验,实验步骤如下:①连接装置,;②装入药品;③打开分液漏斗活塞;④控制温度加热硬质玻璃管一段时间;⑤停止通HCl,升温继续加热;步骤④通HCl的目的是;
(5)、装置E中发生反应的离子方程式是。(6)、(实验分析与改进)装置B中试纸先变蓝后又褪色,经查资料获知过量的Cl2能将I2氧化。甲同学认为可将湿润的淀粉KI试纸改成足量的淀粉KI溶液以克服Cl2过量的问题,但小组分析后认为该方案存在一个明显安全问题:
(7)、反应结束后,CuCl产品中可能含有少量未分解的CuCl2 , 乙同学认为只用一种日常生活常见的液体即可检验。该实验方案为:取少量固体放入小试管中,。四、综合题
-
17. 海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.(1)、在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl
②Cl+H2→HCl+H
③H+Cl2→HCl+Cl
…
反应②中形成的化合物的电子式为;反应③中被破坏的化学键属于键(填“极性”或“非极性”).
(2)、已知在短周期主族元素中,元素a与氯元素相邻且属同一周期,元素b也与氯元素相邻且属于同一主族,那么比较元素a、b以及氯元素三者的原子半径由大到小的顺序是(用元素符号表示).与氯元素同周期且金属性最强的元素位于周期表的第周期族.(3)、卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法错误的是 (填字母).A、卤素单质的熔沸点按F2、Cl、Br2、I2的顺序由低到高 B、原子半径按 C、Cl、Br、I的顺序由大到小 D、卤化氢的稳定性按的H E、HCl、HBr、HI的顺序由强到弱 F、卤素单质与氢气化合按的F2、Cl2、Br2、I2顺序由难变易(4)、碘单质及其化合物具有重要应用.下列说法正确的是(填字母).a. I与 I互为同位素
b.加碘食盐能使淀粉溶液变蓝
c.从海带中提取I2的过程只发生化学变化
d.提纯含泥沙的粗碘可用升华法.
18. 碘缺乏症遍及全球,多发生于山区.南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区.我国云南、河南等10余省的山区发病率也较高.据估计我国患者大约有1000万人.为控制该病的发生,较为有效的方法是食用含碘食盐,我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3).据此回答下列问题:(1)、碘是合成下列哪种激素的主要原料之一A、胰岛素 B、甲状腺激素 C、生长激素 D、雄性激素(2)、长期生活在缺碘山区,又得不到碘盐的供应,易患A、甲状腺亢进 B、佝偻病 C、地方性甲状腺肿 D、糖尿病(3)、可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾.反应的化学方程式为 . 氧化产物与还原产物的物质的量之比为 . 能观察到的明显现象是 .(4)、已知KIO3可用电解方法制得.总反应化学方程式为:KI+3H2O KIO3+3H2↑.在某温度下.若以12A的电流强度电解KI溶液10min.理论上可得标况下氢气 L.19. 某同学在复习元素化合物的性质时,做了如下学习笔记,请你一起完成。(1)、氯气的颜色为;由氯的原子结构示意图推测,氯气具有很强的 性。为了证明推测是否正确,进行如下实验:I:将红热的铁丝伸入盛满氯气的集气瓶,观察铁丝在氯气中燃烧,有大量棕黄色烟。该反应的化学方程式是。
II:在空气中点燃H2 , 然后将导管缓缓伸入盛满氯气的集气瓶,可观察到H2在氯气中安静燃烧,产生色的火焰,瓶口有白雾的现象。
由实验I、II可知,上述推测(填“正确”或“不正确”);理由是。
III:将氯气溶于水,制得氯水。下列物质不能与新制氯水反应的是。
Na2CO3溶液 B.FeCl2溶液 C.AgNO3 溶液 D.CuCl2溶液
(2)、下列是一些常见物质之间的转化关系。A是一种红色金属,F为不溶于酸的白色沉淀,B和C是两种强酸。(图中部分产物及反应条件略去)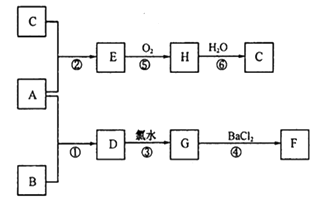
则:①A和B 分别为:A B;
②A与B发生反应的条件是;
③反应⑥的化学方程式为;
④上述反应中,不属于氧化还原反应的是。(填数字序号)。
20. 碘化钠在医学上被广泛应用于X射线造影剂、甲状腺癌防治等方面。实验室可用铁屑还原法制碘化钠。回答下列问题:(1)、向反应容器中加入30mL40%的NaOH溶液、25.4gI2 , 搅拌并加热,发生反应:3I2+6NaOH 5NaI+NaIO3+3H2O。将温度控制在60-70℃的最佳加热方法是 , 若温度过高产生的影响是。(2)、已知:IO3-+5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性。某同学设计如下方案,检验反应后溶液中存在IO3- , 且c(OH-)>c(H+)限选试剂及用品:1 mol·L-1H2SO4、2 mol·L-1HNO3、淀粉KI试纸、红色石蕊试纸、蓝色石蕊试纸实验操作
实验现象
结论
①用玻璃棒蘸取溶液,点在试纸上
试纸呈蓝色
c(OH-)>c(H+)
②用玻璃棒蘸取溶液,点在试纸上
试纸不变色
③向实验②的试纸上滴加溶液
试纸呈蓝色
溶液中有IO3-
(3)、向反应后的溶液中加入铁粉,产生红褐色沉淀,则该反应的离子方程式为。充分反应后,从混合物中获得NaI固体,首先应进行(填操作名称),若后续操作中直接蒸发结晶往往得不到较纯的NaI固体,可能的原因是。为将溶液中的NaIO3全部还原成NaI,投入铁屑的质量不少于g(精确到小数点后两位)。五、真题演练
-
21. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色
X溶液中一定含有Fe2+
B
向浓度均为0.05 mol·L−1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成
Ksp(AgI)> Ksp(AgCl)
C
向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色
Br2的氧化性比I2的强
D
用pH试纸测得:CH3COONa溶液的pH约为
9,NaNO2溶液的pH约为8
HNO2电离出H+的能力比CH3COOH的强
A、A B、B C、C D、D22. W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是A、原子半径大小为W<X<Y<Z B、X的氢化物水溶液酸性强于Z的 C、Y2W2与ZW2均含有非极性共价键 D、标准状况下W的单质状态与X的相同