专题2:离子反应
试卷更新日期:2019-08-29 类型:一轮复习
一、单选题
-
1. 下列物质在水溶液中的电离或水解方程式书写正确的是()A、CH3COO-+H2O=OH-+CH3COOH B、HF+H2O H3O++F- C、H3PO4 3H++PO43- D、NaHCO3 Na++H++CO32-2. 向浓氨水中加入生石灰可以制取氨气,以下不会涉及到的反应是( )A、NH3·H2O NH3+H2O B、NH4++H2O NH3·H2O+H+ C、CaO+H2O→Ca(OH)2 D、NH4++OH- NH3·H2O3. 下列反应能用
 来表示的是() A、澄清石灰水与
来表示的是() A、澄清石灰水与 溶液反应
B、
溶液反应
B、 和
和 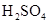 溶液反应
C、NaOH溶液和
溶液反应
C、NaOH溶液和  溶液反应
D、
溶液反应
D、 溶液和HI溶液反应
4. 以下化学反应的产物种类与反应物的浓度、用量和反应条件均无关的是( )A、NH3通入AlCl3溶液中 B、Cu与硝酸反应 C、CO2通入NaOH溶液中 D、Na与O2反应5. 在含有大量Na+、CO32- 、Cl-的溶液中,还可能大量共存的离子是()
溶液和HI溶液反应
4. 以下化学反应的产物种类与反应物的浓度、用量和反应条件均无关的是( )A、NH3通入AlCl3溶液中 B、Cu与硝酸反应 C、CO2通入NaOH溶液中 D、Na与O2反应5. 在含有大量Na+、CO32- 、Cl-的溶液中,还可能大量共存的离子是()
A、Ba2+ B、NO3- C、Ag+ D、H+6. 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( ) A、a点对应的溶液中:Na+、Mg2+、SO42﹣、HCO3﹣ B、b点对应的溶液中:Ag+、Ca2+、NO3﹣、F﹣ C、c点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣ D、d点对应的溶液中:K+、NH4+、I﹣、CO32﹣7. 某澄清水溶液,只可能含有以下离子中的若干种,且各离子物质的量浓度相等(忽略水的电离):Na+、K+、Cl-、Ba2+、CO32-、SO42- , 取少量该溶液于试管,加BaCl2溶液后出现白色沉淀。一定存在的离子有( )A、Ba2+、Cl- B、SO42-、Na+ C、Na+、K+ D、CO32-、SO42-8. pH=12的某溶液中有关数据如下:
A、a点对应的溶液中:Na+、Mg2+、SO42﹣、HCO3﹣ B、b点对应的溶液中:Ag+、Ca2+、NO3﹣、F﹣ C、c点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣ D、d点对应的溶液中:K+、NH4+、I﹣、CO32﹣7. 某澄清水溶液,只可能含有以下离子中的若干种,且各离子物质的量浓度相等(忽略水的电离):Na+、K+、Cl-、Ba2+、CO32-、SO42- , 取少量该溶液于试管,加BaCl2溶液后出现白色沉淀。一定存在的离子有( )A、Ba2+、Cl- B、SO42-、Na+ C、Na+、K+ D、CO32-、SO42-8. pH=12的某溶液中有关数据如下:离子
Na+
Ba2+
NO3-
Cl-
浓度(mol/L)
1.0×10
1.0×10
y
2.0×10
2.0×10
则 和y可能是( )
A、Fe2+;1.0×10 B、K+:1.0×10 C、SO42-:1.0×10 D、I-:2.0×109. 某澄清透明溶液中,可能大量存在下列离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Br-、AlO2-、Cl-、SO42-、CO32- , 现进行如下实验:① 用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出。将溶液分为3份。
② 在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清。加热,将湿润的红色石蕊试纸置于试管口,未见明显现象。
③ 在第2份溶液中加入新制的氯水和CCl4 , 振荡后静置,下层溶液显橙红色。
则下列推断正确的是:( )
A、溶液中一定有K+、Br-、AlO2-、CO32- B、溶液中一定没有NH4+、Mg2+、Cu2+、Cl- C、不能确定溶液中是否有K+、Cl-、SO42- D、往第3份溶液中滴加硝酸酸化的硝酸银溶液可确认是否有Cl-二、填空题
-
10. 书写下列物质在水溶液中的电离方程式:
KCl=
Na2SO4=
BaCl2=
NaHSO4=
NaHCO3= .
11. 按要求填空(1)、酸雨的pH<(2)、制造光导纤维的材料是;三硅酸镁(Mg2Si3O8·11H2O)用氧化物表示。(3)、除去NaHCO3溶液中少量的Na2CO3杂质相应的离子方程式为。(4)、检验SO42-所需要用的试剂。(5)、用氨气检验氯气泄漏的方程式:。(6)、配平下列化学方程式:Zn+HNO3=NH4NO3+Zn(NO3)2+H2O,
12. 某无色溶液只含下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、HCO3-、NO3-。已知该溶液可与Al2O3反应,则:①该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有 , 一定不会含有大量的。
②该溶液与Al2O3反应后有AlO2-生成,则原溶液中一定含有 , 可能含有大量的。
③写出该溶液与Al2O3反应生成AlO2-的离子方程式。
三、综合题
-
13. 在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
阳离子
K+、Ag+、Mg2+、Ba2+
阴离子
NO3-、CO32-、SiO32-、SO42-
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
序号
实验内容
实验结果
Ⅰ
向该溶液中加入足量稀HCl
产生白色沉淀并放出0.56L气体
Ⅱ
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量
固体质量为2.4g
Ⅲ
在Ⅱ的滤液中滴加BaCl2溶液
无明显现象
试回答下列问题:
(1)、实验I能确定一定不存在的阳离子是。(2)、实验I中生成沉淀的离子方程式为。(3)、通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“不能确定”)阴离子
NO3-
CO32-
SiO32-
SO42-
c/mol·L-1
(4)、判断K+是否存在,若存在求其最小浓度(若不存在说明理由)。四、真题演练
-
14. 固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是( )
 A、冰表面第一层中,HCl以分子形式存在 B、冰表面第二层中,H+浓度为5×10−3 mol·L−1(设冰的密度为0.9 g·cm−3) C、冰表面第三层中,冰的氢键网格结构保持不变 D、冰表面各层之间,均存在可逆反应HCl H++Cl−15. 下列指定反应的离子方程式正确的是( )A、室温下用稀NaOH溶液吸收Cl2:Cl2+2OH−=ClO−+Cl−+H2O B、用铝粉和NaOH溶液反应制取少量H2:Al+2OH−= +H2↑ C、室温下用稀HNO3溶解铜:Cu+2 +2H+=Cu2++2NO2↑+H2O D、向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+16. 下列离子方程式能用来解释相应实验现象的是( )
A、冰表面第一层中,HCl以分子形式存在 B、冰表面第二层中,H+浓度为5×10−3 mol·L−1(设冰的密度为0.9 g·cm−3) C、冰表面第三层中,冰的氢键网格结构保持不变 D、冰表面各层之间,均存在可逆反应HCl H++Cl−15. 下列指定反应的离子方程式正确的是( )A、室温下用稀NaOH溶液吸收Cl2:Cl2+2OH−=ClO−+Cl−+H2O B、用铝粉和NaOH溶液反应制取少量H2:Al+2OH−= +H2↑ C、室温下用稀HNO3溶解铜:Cu+2 +2H+=Cu2++2NO2↑+H2O D、向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+16. 下列离子方程式能用来解释相应实验现象的是( )实验现象
离子方程式
A
向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解
B
向沸水中滴加饱和氯化铁溶液得到红褐色液体
C
二氧化硫使酸性高锰酸钾溶液褪色
D
氧化亚铁溶于稀硝酸
A、A B、B C、C D、D17. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、0.1 mol·L−1NaOH溶液:Na+、K+、 、 B、0.1 mol·L−1FeCl2溶液:K+、Mg2+、 、 C、0.1 mol·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH− D、0.1 mol·L−1H2SO4溶液:K+、 、 、18. 硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题:
(1)、在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为。(2)、“滤渣1”的主要成分有。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是。(3)、根据H3BO3的解离反应:H3BO3+H2O H++B(OH)−4 , Ka=5.81×10−10 , 可判断H3BO3是酸;在“过滤2”前,将溶液pH调节至3.5,目的是。(4)、在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为 , 母液经加热后可返回工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是。
-