初中科学浙教版九年级上册2.2 金属的化学性质
试卷更新日期:2019-08-28 类型:同步测试
一、基础题
-
1. 下列金属中,活动性最强的是( )A、镁 B、铜 C、锌 D、铝2. 某兴趣小组的同学向一固体中滴加稀盐酸,产生了无色气体,则该小组的四位同学所得结论中不正确的是( )A、可能为碳酸盐 B、可能为金属铁 C、可能是合金 D、可能是金属铜3. 铁锈的主要成分为( )A、FeSO4 B、Fe2O3 C、FeO D、Fe3O44. 下列措施不能在一定程度上防止金属生锈的是( )A、在金属表面涂油或刷漆 B、在金属表面镀上一层耐腐蚀的铬 C、制成耐腐蚀的合金 D、用砂纸擦去铝制品表面的氧化膜5. 如图为某文化衫图案,你的美(Mg)偷走我的心(Zn)能发生,是由于镁的( )
 A、延展性好 B、导电性好 C、导热性好 D、金属活动性比锌强6. 在AgNO3 和 Cu(NO3)2 的混合溶液中,加入一定量铁粉充分反应后,有少量金属析出,过滤后,向滤液中滴加稀盐酸,有白色沉淀生成,则滤纸上的少量金属是( )A、Cu B、Ag C、Fe 和 Cu D、Cu和 A g7. 在柠檬中插入两种不同的金属可以制得水果电池。相同条件下,水果电池的电压与两种金属的活动性差异大小有关。下列柠檬电池的两种金属,活动性差异最小的是( )A、
A、延展性好 B、导电性好 C、导热性好 D、金属活动性比锌强6. 在AgNO3 和 Cu(NO3)2 的混合溶液中,加入一定量铁粉充分反应后,有少量金属析出,过滤后,向滤液中滴加稀盐酸,有白色沉淀生成,则滤纸上的少量金属是( )A、Cu B、Ag C、Fe 和 Cu D、Cu和 A g7. 在柠檬中插入两种不同的金属可以制得水果电池。相同条件下,水果电池的电压与两种金属的活动性差异大小有关。下列柠檬电池的两种金属,活动性差异最小的是( )A、 B、
B、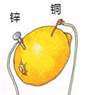 C、
C、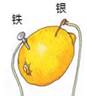 D、
D、 8. 小明把足量的X放入Y(NO3)2和Z(NO3)2的混合溶液中,充分反应后过滤,滤渣中只有X、Z。据此判断这三种金属的活动性由强到弱的顺序为( )
8. 小明把足量的X放入Y(NO3)2和Z(NO3)2的混合溶液中,充分反应后过滤,滤渣中只有X、Z。据此判断这三种金属的活动性由强到弱的顺序为( )
A、Y>X>Z B、Y>Z>X C、X>Y>Z D、X>Z>Y9. 某工厂排放的废水中含有较多的硫酸铜,从回收利用和防止重金属污染的角度考虑,切实可行的方案是在废水中加入( )A、食盐 B、盐酸 C、碳酸钙 D、铁粉10. 为验证Mg、Cu、Ag三种金属的活动性强弱,某科学兴趣小组设计了如图所示的四个实验,其中不必进行的实验是( )
A、 B、
B、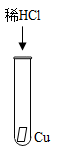 C、
C、 D、
D、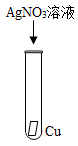 11. “药金”俗称黄铜,是锌和铜的合金,因外形酷似黄金而得名。利用下列厨房用品就能鉴别“药金”为假黄金的是( )A、食盐水 B、白醋 C、料酒 D、酱油12. 下列环境中,铁钉表面最容易产生铁锈的是( )A、在稀盐酸中 B、在潮湿的空气中 C、在干燥的空气中 D、浸没在植物油中13. 金属腐蚀的快慢与外界条件密切相关。下列条件下,铁钉的腐蚀速度最快的是( )A、
11. “药金”俗称黄铜,是锌和铜的合金,因外形酷似黄金而得名。利用下列厨房用品就能鉴别“药金”为假黄金的是( )A、食盐水 B、白醋 C、料酒 D、酱油12. 下列环境中,铁钉表面最容易产生铁锈的是( )A、在稀盐酸中 B、在潮湿的空气中 C、在干燥的空气中 D、浸没在植物油中13. 金属腐蚀的快慢与外界条件密切相关。下列条件下,铁钉的腐蚀速度最快的是( )A、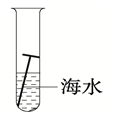 B、
B、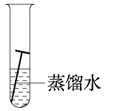 C、
C、 D、
D、 14. 下列方程式中错误的是( )A、Fe + CuCl2 = FeCl2 + Cu B、Fe + 2HCl = FeCl2 + H2↑ C、Cu + ZnSO4 = Zn+ CuSO4 D、2Cu + O2
14. 下列方程式中错误的是( )A、Fe + CuCl2 = FeCl2 + Cu B、Fe + 2HCl = FeCl2 + H2↑ C、Cu + ZnSO4 = Zn+ CuSO4 D、2Cu + O2 2CuO
2CuO
二、中档题
-
15. 将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,充分反应后过滤。向得到的滤渣和滤液中分别加入足量的稀盐酸,均无现象。则滤渣中( )A、一定有银,可能有铜和锌 B、一定有银,可能有铜,一定没有锌 C、一定有银和铜,可能有锌 D、一定有银和铜,一定没有锌16. 小丽为确认所回收易拉罐的主要成分是铝还是铁,剪取金属片打磨后,设计了如图所示的两种不同方法进行检验,这样设计的依据是( )
 A、铁、铝有不同的物理性质 B、活泼金属易与氧气反应 C、排在氢前面的金属可以把酸中的氢置换出来 D、活动性较强的金属可把活动性较弱的金属从它的盐溶液中置换出来17. 下列现象和事实,可用金属活动性顺序作出合理解释的是( )
A、铁、铝有不同的物理性质 B、活泼金属易与氧气反应 C、排在氢前面的金属可以把酸中的氢置换出来 D、活动性较强的金属可把活动性较弱的金属从它的盐溶液中置换出来17. 下列现象和事实,可用金属活动性顺序作出合理解释的是( )①金属镁在空气中比铝更易点燃,说明镁比铝活动性强;
②金属铝比金属锌更耐腐蚀,说明锌比铝活动性强;
③硫酸铜、石灰乳配制农药波尔多液,不宜用铁制容器;
④金属锌与稀硫酸反应速率适中,更适于实验室制取氢气。
A、①② B、③④ C、①③④ D、①②③④18. 向AgNO3溶液中加入一定质量的铜锌混合粉末,充分反应后过滤,得到滤渣和滤液。下列说法正确的是( )A、滤液中加入稀HCl,一定有沉淀产生 B、滤渣中加入稀HCl,一定没有气体产生 C、滤渣中一定没有Zn,但一定有Ag、Cu D、滤渣中一定有Ag,可能有Cu、Zn19. 向CuSO4溶液中加入一定量的铁粉充分反应后,下列情况不可能出现的是( )A、溶液中有Fe2+ , 不溶物为Fe、Cu B、溶液中有Fe2+ , 不溶物为Cu C、溶液中有Fe2+、Cu2+ , 不溶物为Cu D、溶液中有Fe2+、Cu2+ , 不溶物为Fe20. 向盛有Fe(NO3)2、AgNO3的溶液中加入一定量的Zn粉,充分反应后过滤,得到滤渣和无色滤液两部分:(1)、滤渣中一定含有的金属是;(2)、请写出Zn粉与AgNO3溶液反应的化学方程式21. 一些金属易生锈,某小组同学设计如下实验,对金属锈蚀进行探究。取5枚去油去锈的洁净铁钉,分别装入下表的试管中,进行实验。
通过上述实验可知,温度越高铁钉生锈速率越(填“慢”或“快”);在(填“酸性”、“碱性”或“中性”)环境中铁钉生锈速率较快。实验
图示





生锈
时间
8min
较长时间不生锈
5min
3min
1min
三、拓展题
-
22. 某兴趣小组为探究锡纸中的金属成分(锡纸中以一种金属为主,其它成分对实验无干扰),开展了以下探究活动。
【提出问题】锡纸中的金属是什么?
【建立猜想】根据锡纸有银白色金属光泽,并结合金属活动性、价格等因素,猜想其中的金属可能是锌、铁、铝、锡中的一种。
【探究过程】
步骤
活动内容
收集证据
分析并得出结论
步骤一
①查阅资料:金属锌在室温下很脆
②取锡纸反复折叠
锡纸未破损
锡纸中金属不是锌
步骤二
用磁铁靠近锡纸
锡纸没有被磁铁吸引
锡纸中金属不是
步骤三
①取锡纸条放入浓度为20%的盐酸中除去可能存在的氧化膜。当观察到现象时,取出锡纸条并用蒸馏水清洗。
②将处理过的锡纸条放入试管中,加入饱和硫酸锌溶液,静置观察。
②中锡纸条表面无明显现象
说明锡纸中的金属活动性比锌弱,则锡纸中金属不是铝,而是锡
【交流评价】小科对实验结论提出质疑:“无明显现象”并不代表没有发生反应,因为铝与硫酸锌反应[2Al+3ZnSO4=3Zn+Al2(SO4)3]生成的金属锌为银白色,与铝颜色相同,因此无法得出结论。请在不改变反应原理的前提下运用定量方法完善实验方案,并根据预期结果得出相应结论: 。
【继续探究】运用完善后的方案进行实验,分析实验结果,得出初步结论:锡纸中金属是铝。