2017年广东省深圳市中考化学试卷
试卷更新日期:2017-06-26 类型:中考真卷
一、选择题(本部分共10小题,在每小题给出的四个选项中,只有一项符合题目要求。)
-
1. 下列化学用语表示正确的是( )A、五氧化二磷的化学式:P2O5 B、硅的元素符号:SI C、碳酸根离子:CO3 D、三个氧原子:O32. 化学与生产、生活密切相关。下列说法错误的是( )A、干冰可作制冷剂,广泛用于食品冷藏保鲜 B、N2、NO、NO2等含氮物质均为空气污染物 C、明矾溶于水的胶状物可吸附杂质,达到净水的目的 D、废旧电池的分类回收有利于保护环境3. 规范的实验操作是安全地进行实验并获得成功的保证。下列实验操作正确的是( )A、
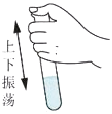 振荡试管充分反应
B、
振荡试管充分反应
B、 溶解NaCl固体
C、
溶解NaCl固体
C、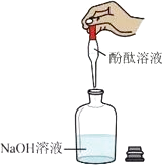 检验溶液的酸碱性
D、
检验溶液的酸碱性
D、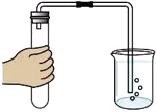 检查装置的气密性
4. 下列说法中正确的是( )A、检验电解水的产物,可判断水的组成元素 B、将pH试纸用水湿润后,测定柠檬汁的pH C、凡是无色的、均一的液体一定是溶液 D、硫在O2中燃烧发出淡蓝色火焰,生成SO35.
检查装置的气密性
4. 下列说法中正确的是( )A、检验电解水的产物,可判断水的组成元素 B、将pH试纸用水湿润后,测定柠檬汁的pH C、凡是无色的、均一的液体一定是溶液 D、硫在O2中燃烧发出淡蓝色火焰,生成SO35.碘是人体必需的微量元素之一,有“智力元素”之称。下图为碘在元素周期表中的相关信息及原子结构示意图,据此判断下列说法正确的是( )
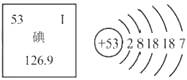 A、碘是一种金属元素 B、碘原子的核外有7个电子层 C、碘原子的核电荷数为53 D、碘的相对原子质量为126.9g6. 丙氨酸是一种常见的氨基酸,其化学式为C3HxO2N,相对分子质量是89.下列说法正确的是( )A、丙氨酸属于无机化合物 B、丙氨酸中碳、氮元素的质量比为3:1 C、丙氨酸化学式中x=7 D、每个丙氨酸分子中含有一个氧气分子7.
A、碘是一种金属元素 B、碘原子的核外有7个电子层 C、碘原子的核电荷数为53 D、碘的相对原子质量为126.9g6. 丙氨酸是一种常见的氨基酸,其化学式为C3HxO2N,相对分子质量是89.下列说法正确的是( )A、丙氨酸属于无机化合物 B、丙氨酸中碳、氮元素的质量比为3:1 C、丙氨酸化学式中x=7 D、每个丙氨酸分子中含有一个氧气分子7.“催化转化器”可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图。

下列说法正确的是( )
A、该反应中四种物质均为化合物 B、该反应前后原子数目发生改变 C、甲、丁中同种元素化合价相同 D、乙、丙中所含元素种类相同8. 为了达到相应的实验目的,下列实验设计不合理的是( )A、 分离H2O2和MnO2制O2后的固液混合物
B、
分离H2O2和MnO2制O2后的固液混合物
B、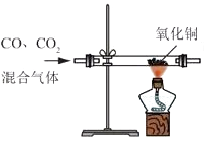 除去CO中的CO2气体
C、
除去CO中的CO2气体
C、 区分NaCl、NH4NO3、NaOH三种固体
D、
区分NaCl、NH4NO3、NaOH三种固体
D、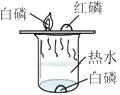 探究可燃物燃烧的条件
9.
探究可燃物燃烧的条件
9.下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是( )
 A、甲的溶解度大于乙的溶解度 B、a1℃时,甲、乙饱和溶液的温度升温至a2℃时,均有固体析出 C、a2℃时,M点对应的甲溶液不饱和 D、a2℃时,乙饱和溶液的质量分数为20%10. 小明同学归纳总结了初中所学稀硫酸的化学性质,并用“H2SO4+X→盐+Y”这种表达式进行整理。下列小明的观点错误的是( )
A、甲的溶解度大于乙的溶解度 B、a1℃时,甲、乙饱和溶液的温度升温至a2℃时,均有固体析出 C、a2℃时,M点对应的甲溶液不饱和 D、a2℃时,乙饱和溶液的质量分数为20%10. 小明同学归纳总结了初中所学稀硫酸的化学性质,并用“H2SO4+X→盐+Y”这种表达式进行整理。下列小明的观点错误的是( )选项
X的物质类别
观点描述
A
金属
若X为Cu,则反应能够发生
B
金属氧化物
若X为MgO,则Y为H2O
C
碱
若X为NaOH,则盐谓Na2SO4
D
盐
若X为BaCl2 , 则生成白色沉淀
A、A B、B C、C D、D二、非选择题
-
11.
甲、乙、丙是初中化学常见物质。这些物质之间的转化关系如下图所示。

根据以上信息,请回答下列问题。
(1)、写出甲的化学式。(2)、写出反应①的化学方程式。(3)、写出反应②的化学方程式。该反应属于反应(填基本反应类型)。(4)、反应③在一定温度下进行,若乙为Fe2O3 , 则丙为Fe;若丙为Cu,则乙为(填化学式)。(5)、请完成下列表格,证明Fe的金属活动性比Cu的强。实验方案
实验现象
将铁片浸入(填化学式)溶液中
铁片表明析出固体
12.我国著名化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3 , 化学方程式:NaCl+ NH3+CO2+H2O= NaHCO3↓+NH4Cl
某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
 (1)、I.气体制备
(1)、I.气体制备①二氧化碳气体制备实验室常采用石灰石与稀盐酸反应制备CO2 , 其化学方程式为。应选择的气体收集装置为(选填装置对应的字母)。
②氨气制备
实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固) CaCl2+2H2O+2NH3↑。现要制备并干燥NH3 , 所选装置的正确连接顺序为→(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式。
(2)、NaHCO3制备①根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因。
物质
NaHCO3
NH4Cl
溶解度/g(20℃)
9.6
37.2
②该过程中另一产物NH4Cl在农业生产中常被用作。
13. 我国矿物种类齐全,储量丰富。工业上从从含有金属元素的矿石中提炼金属。其中赤铁矿是炼铁的主要原料。请回答下列问题:(1)、铁制品广泛应用于生产、生活中。
①下列不属于铁合金的是(选填字母)。
A.Fe(OH)3 B.生铁 C.不锈钢
②铁钉生锈,属于变化(选填“物理”“化学”):下图是探究铁钉在不同条件下发生生锈的实验,其中铁锈蚀最快的是(选填字母)。
 (2)、
(2)、赤铁矿(主要成分为Fe2O3)可用于生产催化剂。
Ⅰ.在Fe2O3中,氧元素的质量分数为。
Ⅱ.赤铁矿经提纯后得到的纯净Fe2O3可用于生产某种工业催化剂(主要成分为FeO和Fe2O3),其反应原理为:2 Fe2O3+C 4FeO+CO2↑。现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,下图为固体混合物的质量随反应时间的变化曲线。

①由图可知:生成CO2气体的质量为g。
②计算反应后固体混合物中FeO的质量分数(请根据化学方程式写出完整的计算步骤) 。