2017年高考化学真题试卷(海南卷)
试卷更新日期:2017-06-26 类型:高考真卷
一、选择题:本题共6小题,每小题2分,共12分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 下列说法错误的是( )A、蔗糖可作调味剂 B、细铁粉可作食品抗氧剂 C、双氧水可作消毒剂 D、熟石灰可作食品干燥剂2. 分别将足量下列气体通入稀Na2S溶液中,可以使溶液变浑浊的是( )A、CO B、SO2 C、HCl D、CO23. 下列分子中,其中子总数为24的是( )A、18O3 B、2H217O2 C、14N16O2 D、14C16O24. 在酸性条件下,可发生如下反应:
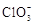 +2M3++4H2O=
+2M3++4H2O= 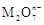 +Cl+8H+ ,
+Cl+8H+ , 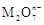 中M的化合价是( ) A、+4 B、+5 C、+6 D、+75. 下列危险化学品标志中表示腐蚀品的是( )A、
中M的化合价是( ) A、+4 B、+5 C、+6 D、+75. 下列危险化学品标志中表示腐蚀品的是( )A、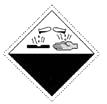 B、
B、 C、
C、 D、
D、 6. 能正确表达下列反应的离子方程式为( )A、用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O B、硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+ C、向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3
6. 能正确表达下列反应的离子方程式为( )A、用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O B、硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+ C、向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3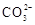 =Al2(CO3)3↓
D、用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH=
=Al2(CO3)3↓
D、用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH=  +
+  + H2O
+ H2O
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
-
7. 下列叙述正确的是( )A、稀硫酸和铜粉反应可制备硫酸铜 B、碘化钾与浓硫酸反应可制备碘化氢 C、过氧化钠与二氧化碳反应可制备氧气 D、铝箔在氯气中燃烧可制备无水三氯化铝8. 下列叙述正确的是( )A、酒越陈越香与酯化反应有关 B、乙烷、丙烷和丁烷都没有同分异构体 C、乙烯和聚氯乙烯都能使溴的四氯化碳溶液褪色 D、甲烷与足量氯气在光照下反应可生成难溶于水的油状液体9. NA为阿伏加德罗常数的值。下列叙述错误的是( )A、1 mol 乙烯分子中含有的碳氢键数为4NA B、1 mol 甲烷完全燃烧转移的电子数为8NA C、1 L 0.1 mol·L−1的乙酸溶液中含H+的数量为0.1NA D、1 mol 的CO和N2混合气体中含有的质子数为14NA10.
一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+。下列叙述错误的是( )
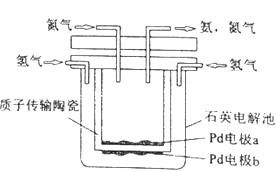 A、Pb电极b为阴极 B、阴极的反应式为:N2+6H++6e−=2NH3 C、H+由阳极向阴极迁移 D、陶瓷可以隔离N2和H211. 已知反应CO(g)+H2O(g)
A、Pb电极b为阴极 B、阴极的反应式为:N2+6H++6e−=2NH3 C、H+由阳极向阴极迁移 D、陶瓷可以隔离N2和H211. 已知反应CO(g)+H2O(g)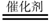 CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( ) A、升高温度,K减小 B、减小压强,n(CO2)增加 C、更换高效催化剂,α(CO)增大 D、充入一定量的氮气,n(H2)不变12. 下列实验操作正确的是( )A、滴定前用待测液润洗锥形瓶 B、容量瓶和滴定管使用前均需要检漏 C、蒸馏完毕时,先关闭冷凝水,再停止加热 D、分液时,下层溶液先从下口放出,上层溶液再从上口倒出
CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( ) A、升高温度,K减小 B、减小压强,n(CO2)增加 C、更换高效催化剂,α(CO)增大 D、充入一定量的氮气,n(H2)不变12. 下列实验操作正确的是( )A、滴定前用待测液润洗锥形瓶 B、容量瓶和滴定管使用前均需要检漏 C、蒸馏完毕时,先关闭冷凝水,再停止加热 D、分液时,下层溶液先从下口放出,上层溶液再从上口倒出三、非选择题:共64分。第13~17题为必考题,每个试题考生都必须作答。第18、19题为选考题,考生根据要求作答。(一)必考题(共44分)
-
13. X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:(1)、X与L组成的最简单化合物的电子式为。(2)、X与M组成的物质为(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为。(3)、Y在周期表中的位置是 , 其含氧酸的化学式为。(4)、L与M形成的化合物中L的化合价是。14. 碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:(1)、碳酸钠俗称 , 可作为碱使用的原因是(用离子方程式表示)。(2)、已知:①2NaOH(s)+CO2(g)
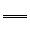 Na2CO3(s)+H2O(g) ΔH1=−127.4 kJ·mol−1
Na2CO3(s)+H2O(g) ΔH1=−127.4 kJ·mol−1②NaOH(s)+CO2(g)
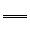 NaHCO3(s) ΔH1=−131.5 kJ·mol−1
NaHCO3(s) ΔH1=−131.5 kJ·mol−1反应2Na2CO3(s)
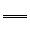 Na2CO3(s)+ H2O(g) +CO2(g)的ΔH= kJ·mol−1 , 该反应的平衡常数表达式K=。(3)、向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中
Na2CO3(s)+ H2O(g) +CO2(g)的ΔH= kJ·mol−1 , 该反应的平衡常数表达式K=。(3)、向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中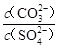
=。已知Ksp(BaCO3)=2.6×10−9 , Ksp(BaSO4)=1.1×10−10。
15. 已知苯可以进行如下转化: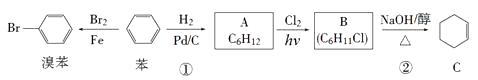
回答下列问题:
(1)、反应①的反应类型为 , 化合物A的化学名称为。(2)、化合物B的结构简式为 , 反应②的反应类型为。(3)、如何仅用水鉴别苯和溴苯。16. 锂是最轻的活泼金属,其单质及其化合物有广泛的用途。回答下列问题:(1)、用碳酸锂和反应可制备氯化锂,工业上可由电解LiCl-KCl的熔融混合物生产金属锂,阴极上的电极反应式为。(2)、不可使用二氧化碳灭火器扑灭因金属锂引起的火灾,其原因是。(3)、硬脂酸锂是锂肥皂的主要成分,可作为学科&网高温润滑油和油脂的稠化剂。鉴别硬脂酸锂与硬脂酸钠、硬脂酸钾可采用的实验方法和现象分别是。(4)、LiPF6易溶于有机溶剂,常用作锂离子电池的电解质。LiPF6受热易分解,其热分解产物为PF3和。17. 以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示: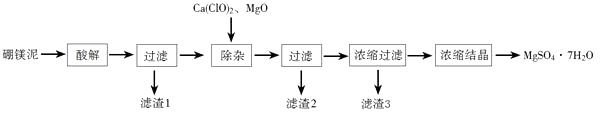
硼镁泥的主要成分如下表:
MgO
SiO2
FeO、Fe2O3
CaO
Al2O3
B2O3
30%~40%
20%~25%
5%~15%
2%~3%
1%~2%
1%~2%
回答下列问题:
(1)、“酸解”时应该加入的酸是 , “滤渣1”中主要含有(写化学式)。(2)、“除杂”时加入次氯酸钙、氧化镁的作用分别是、。(3)、判断“除杂”基本完成的检验方法是。(4)、分离滤渣3应趁热过滤的原因是。四、(二)选考题:共20分。请考生从第18、19题中任选一题作答。如果多做,则按所做的第一题计分。第18、19题中,第Ⅰ题为选择题,在给出的四个选项中,有两个选项是符合题目要求的,请将符合题目要求的选项标号填在答题卡相应位置;第Ⅱ题为非选择题,请在答题卡相应位置作答并写明小题号。
-
18. [选修5:有机化学基础](1)、18-Ⅰ.
香茅醛(
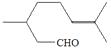 )可作为合成青蒿素的中间体,关于香茅醛的叙述正确的有( )A、分子式为C10H18O B、不能发生银镜反应 C、可使酸性KMnO4溶液褪色 D、分子中有7种不同化学环境的氢(2)、18-Ⅱ.
)可作为合成青蒿素的中间体,关于香茅醛的叙述正确的有( )A、分子式为C10H18O B、不能发生银镜反应 C、可使酸性KMnO4溶液褪色 D、分子中有7种不同化学环境的氢(2)、18-Ⅱ.当醚键两端的烷基不相同时(R1-O-R2 , R1≠R2),通常称其为“混醚”。若用醇脱水的常规方法制备混醚,会生成许多副产物:
R1—OH+ R2—OH
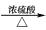 R1—O—R2+ R1—O—R1+ R2—O—R2+H2O
R1—O—R2+ R1—O—R1+ R2—O—R2+H2O一般用Williamson反应制备混醚:R1—X+ R2—ONa→R1—O—R2+NaX,某课外研究小组拟合成
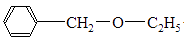 (乙基苄基醚),采用如下两条路线进行对比:
(乙基苄基醚),采用如下两条路线进行对比:Ⅰ:
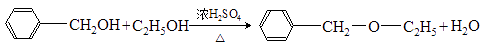
Ⅱ:①
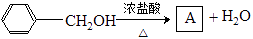
②
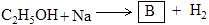
③
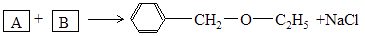
回答下列问题:
1)路线Ⅰ的主要副产物有、。
2)A的结构简式为。
3)B的制备过程中应注意的安全事项是。
4)由A和B生成乙基苄基醚的反应类型为。
5)比较两条合成路线的优缺点:。
6)苯甲醇的同分异构体中含有苯环的还有种。
7)某同学用更为廉价易得的甲苯替代苯甲醇合成乙基苄基醚,请参照路线Ⅱ,写出合成路线。
19. [选修3:物质结构与性质](1)、19-Ⅰ下列叙述正确的有( )
A、某元素原子核外电子总数是最外层学@科网电子数的5倍,则其最高正价为+7 B、钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能 C、高氯酸的酸性与氧化性均大于次氯酸的酸性和氧化性 D、邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点(2)、19-ⅡⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为 , 原子间存在的共价键类型有 , 碳原子的杂化轨道类型为。
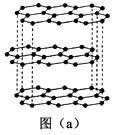
2)SiCl4分子的中心原子的价层电子对数为 , 分子的立体构型为 , 属于分子(填“极性”或“非极性”)。
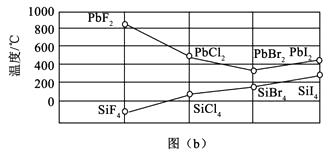
3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性、共价性。(填“增强”“不变”或“减弱”)
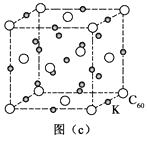
4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为;其晶胞参数为1.4 nm,晶体密度为
g·cm-3。