江苏省镇江市2019年中考化学试卷
试卷更新日期:2019-08-27 类型:中考真卷
一、单选题
-
1. 下列属于纯净物的是()A、食用醋 B、葡萄酒 C、蒸馏水 D、酸牛奶2. 下列物质的用途主要与其化学性质有关的是()A、金刚石用于切割玻璃 B、高粱常用于酿制白酒 C、铜常用来做电线电缆 D、干冰可用作人工降雨3. 下列化学用语正确的是()A、二个氮分子---- B、氦气---- C、二硫化碳--- D、锌离子---4. 下列做法正确的是()A、高温煮沸,杀菌消毒 B、霉变大米,清洗食用 C、深埋电池,消除污染 D、食品防腐,硫磺熏蒸5. 下列归类正确的是()
选项
归类
内容
A
常见的碱
纯碱、氨水、火碱
B
挥发性酸
浓盐酸、浓硫酸、浓硝酸
C
大气污染物
、二氧化硫、二氧化碳
D
有机高分子材料
聚乙烯、聚氯乙烯、有机玻璃
A、A B、B C、C D、D6. 下图是实验室制取并收集氢气的主要操作,其中错误的是()A、检查气密性 B、加入锌粒
B、加入锌粒  C、产生氢气
C、产生氢气  D、收集氢气
D、收集氢气  7. 下列实验方法正确的是()A、用 量筒量取 的水 B、用水电解实验说明水由氢、氧元素组成 C、用活性炭使硬水转化为软水 D、观察颜色区分黄金和黄铜(铜锌合金)8. 下列排序正确的是()A、磷元素的化合价: B、铜元素的质量分数: C、使用合金的年代:
7. 下列实验方法正确的是()A、用 量筒量取 的水 B、用水电解实验说明水由氢、氧元素组成 C、用活性炭使硬水转化为软水 D、观察颜色区分黄金和黄铜(铜锌合金)8. 下列排序正确的是()A、磷元素的化合价: B、铜元素的质量分数: C、使用合金的年代: D、金属单质的导电性:
D、金属单质的导电性: 9. 下列对实验现象的描述或实验操作正确的是()A、镁条在空气中燃烧,产生大量白雾 B、高锰酸钾制取氧气后,试管趁热清洗 C、碘化钾溶液和硝酸银溶液混合,生成黑色沉淀 D、粗盐提纯实验中,待滤悬浊液静置后过滤10. 下图是甲转化为丁的微观过程。下列说法正确的是()
9. 下列对实验现象的描述或实验操作正确的是()A、镁条在空气中燃烧,产生大量白雾 B、高锰酸钾制取氧气后,试管趁热清洗 C、碘化钾溶液和硝酸银溶液混合,生成黑色沉淀 D、粗盐提纯实验中,待滤悬浊液静置后过滤10. 下图是甲转化为丁的微观过程。下列说法正确的是() A、转化①中原子种类不变,个数改变 B、转化②是化合反应 C、整个过程中共有2种氧化物 D、物质丁是复合肥11. 下列指定反应的化学方程式正确的是()A、酸雨形成的原因 B、证明铜的活动性大于银: C、用含氢氧化铝的药物治疗胃酸过多: D、超氧化钾( )与二氧化碳反应生成碳酸钾和氧气:12. 电解饱和氯化钠溶液的化学方程式: 下列说法中错误的是()
A、转化①中原子种类不变,个数改变 B、转化②是化合反应 C、整个过程中共有2种氧化物 D、物质丁是复合肥11. 下列指定反应的化学方程式正确的是()A、酸雨形成的原因 B、证明铜的活动性大于银: C、用含氢氧化铝的药物治疗胃酸过多: D、超氧化钾( )与二氧化碳反应生成碳酸钾和氧气:12. 电解饱和氯化钠溶液的化学方程式: 下列说法中错误的是()
A、 可用于自来水生产中杀菌消毒 B、农业上常用 改良酸性土壤 C、反应中有2种元素化合价发生改变 D、 可由海水蒸发结晶、精制获得13. 下列物质的转化在给定条件下均能实现的是()A、 B、 C、 D、14. 下列实验操作能达到实验目的的是()选项
物质
目的
主要实验操作
A
和
鉴别
分别用燃着的木条试验,观察现象
B
溶液中混有少量盐酸
检验
取样,滴加 溶液,观察是否产生沉淀
C
溶液中混有少量
除杂
加入 溶液至不再产生沉淀,过滤
D
和 的混合溶液
分离
加入过量的 溶液,过滤、洗涤,再分别向滤渣和滤液中加入适量稀盐酸
A、A B、B C、C D、D15. 向 溶液中加入m克 和 的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得 固体。向滤液中滴加 溶液,产生白色沉淀。下列说法正确的是()A、滤液的质量是 B、混合粉末的质量范围是 C、固体中加入稀盐酸可能会有气体生成 D、原 溶液的溶质质量分数是16. 下列说法正确的是()A、金刚石、石墨、 都是碳单质 B、铝的金属活动性比铁强,所以铁比铝更加耐腐蚀 C、某气体不能使带火星木条复燃,该气体中一定不含氧气 D、使饱和溶液析出晶体,溶质质量和溶质质量分数都一定减小17. 下列各组溶液,不用其他试剂就能鉴别出来的是()A、 B、 、稀 C、 、稀 、稀 D、二、多选题
-
18. T1℃ 时,将等质量的 分别加入到各盛有 水的两个烧杯中,充分搅拌后恢复到 T1℃ ,现象如图1、2所示。下列说法正确的是()
图1
 图2
图2  A、甲中加入的固体是 B、甲中溶液可能是该溶质的饱和溶液,乙中上层清液一定是该溶质的饱和溶液 C、将甲、乙中的物质混合,充分搅拌,一定有固体剩余 D、若将甲、乙的温度从 T1℃ 升高到 T2℃ ,两溶液中的溶质质量分数相等19. 有 和 的混合溶液 ,先向其中滴加 溶液,再滴加 的 溶液,产生沉淀质量与滴加溶液质量关系如图所示。下列说法正确的是()
A、甲中加入的固体是 B、甲中溶液可能是该溶质的饱和溶液,乙中上层清液一定是该溶质的饱和溶液 C、将甲、乙中的物质混合,充分搅拌,一定有固体剩余 D、若将甲、乙的温度从 T1℃ 升高到 T2℃ ,两溶液中的溶质质量分数相等19. 有 和 的混合溶液 ,先向其中滴加 溶液,再滴加 的 溶液,产生沉淀质量与滴加溶液质量关系如图所示。下列说法正确的是() A、a点溶液呈中性 B、b~c段只发生了1个反应。 C、c点对应的沉淀有2种, D、原混合溶液中铁、硫元素质量比是20. 已知 右下图为模拟和气处理并得到轻质 的主要流程。下列说法正确的是()
A、a点溶液呈中性 B、b~c段只发生了1个反应。 C、c点对应的沉淀有2种, D、原混合溶液中铁、硫元素质量比是20. 已知 右下图为模拟和气处理并得到轻质 的主要流程。下列说法正确的是() A、净化时用石灰乳而不用石灰水,是为了充分吸收 B、净化时反应的化学方程式: C、沉淀时应先通入 后,再通入 ,有利于 的生成 D、由沉淀池中发生的反应可知,溶解性:
A、净化时用石灰乳而不用石灰水,是为了充分吸收 B、净化时反应的化学方程式: C、沉淀时应先通入 后,再通入 ,有利于 的生成 D、由沉淀池中发生的反应可知,溶解性:三、填空题
-
21. 用化学符号表示:(1)、水银(2)、2个钠离子(3)、人体缺少元素会导致甲状腺疾病。(4)、最常用的溶剂22. 选择下列适当的物质填空(选填序号):
A.明矾 B.硝酸 C.洗洁精 D.熟石灰 E.硫酸 F.食盐 G.维生素 H.硝酸铵
(1)、溶于水温度降低的是 .(2)、生活中作乳化剂的是(3)、铅蓄电池含有的酸是 .(4)、厨房中作调味品的是 .(5)、可配制波尔多液的是(6)、蔬菜,水果中富含有23. 合金是重要的金属材料. (1)、 按其一定比例熔合后冷却可得到储氢合金材料。该过程属于变化(选填“物理”或“化学”)(2)、图中能表示锡铅合金的是(选填“a”“b”或“c”)24. 根据下图实验,回答问题:
(1)、 按其一定比例熔合后冷却可得到储氢合金材料。该过程属于变化(选填“物理”或“化学”)(2)、图中能表示锡铅合金的是(选填“a”“b”或“c”)24. 根据下图实验,回答问题: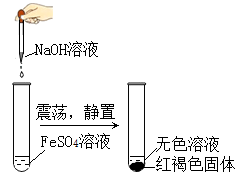 (1)、 中硫元素的化合价为。(2)、生成红褐色固体的总反应的化学方程式为 .
(1)、 中硫元素的化合价为。(2)、生成红褐色固体的总反应的化学方程式为 .提示:① 在空气中极易被氧化。
②方程式中 的配平系数为4.
四、流程题
-
25. 用废铜屑生产硫酸铜晶体 的流程如下:
 (1)、“溶解”时需要加热,但温度不宜过高,原因是 .(2)、“系列操作”包括:除杂、蒸发浓缩、、过滤等。过滤时用到的玻璃仪器有烧杯,漏斗、。(3)、“洗涤”时为减少晶体损失,最好选用(选填序号)。
(1)、“溶解”时需要加热,但温度不宜过高,原因是 .(2)、“系列操作”包括:除杂、蒸发浓缩、、过滤等。过滤时用到的玻璃仪器有烧杯,漏斗、。(3)、“洗涤”时为减少晶体损失,最好选用(选填序号)。a.热水 b.冰水 c.95%的酒精溶液
五、实验题
-
26. 请结合下图回答问题:
 (1)、仪器名称:① , ②。(2)、实验室用氯酸钾和二氧化锰制取并收集 ,可选用发生装置(选序号)和收集装置D组合,反应的化学方程式为(3)、实验室制取 的化学方程式为 , 用装置C相对于B的优点是 , 可用装置E收集,理由是 .(4)、实验室用 和稀 反应制取 。 是有毒气体,能溶于水,其水溶液为氢硫酸。
(1)、仪器名称:① , ②。(2)、实验室用氯酸钾和二氧化锰制取并收集 ,可选用发生装置(选序号)和收集装置D组合,反应的化学方程式为(3)、实验室制取 的化学方程式为 , 用装置C相对于B的优点是 , 可用装置E收集,理由是 .(4)、实验室用 和稀 反应制取 。 是有毒气体,能溶于水,其水溶液为氢硫酸。①制取 的化学方程式为
②图中“防倒吸装置”应选择(选填“甲”或“乙”)

③ 溶液的作用是 .
六、科学探究题
-
27. 草酸( )是一种酸,易溶于水。(1)、(一)草酸的化学性质
草酸溶液的pH7(选填“>”“<”或“=”)。
(2)、草酸溶液中加入石灰水,生成草酸钙( )固体,该反应的化学方程式为(3)、(二) 热分解探究资料:
兴趣小组成一定量的 固体,在老师的指导下用下图装置进行实验。
实验一

实验二

实验一:先通入 ,再加热相应固体,一段时间后停止加热,缓缓通入 至试管冷却。
装置B增重 ,装置B中发生反应的化学方程式为
(4)、装置C中观察到的现象,说明反应生成 。(5)、②中温度升高,则剩余固体中含有 , ③中产生2.2g气体。将③中溶液蒸发得 固体 22.2g 。
(6)、结论:①取用的 CaC2O4 固体的质量为g。
②结合实验及相关数据,本实验中 CaC2O4 分解的总反应化学方程式为
七、推断题
-
28. 现有一包固体粉末,可能含有 中的一种或几种。进行如下实验:(1)、取少量固体溶于足量水中,过滤得到白色固体A和无色滤液B,则原固体中一定不含有 .(2)、向固体A中加入足量稀盐酸,固体全部溶解,无气泡产生,则原固体中一定含有一定不含有。(3)、向滤液B中通入 ,产生白色沉淀,则原固体中一定还含有,一定不含有。29. 如图为某些物质间的转化关系(部分反应条件省略)。A、B、E、F、G均为气体,B能使稀高锰酸钾溶液退色,E、F组成元素相同,且F有毒,G是一种最轻的气体;乙、丁均为黑色的固体氧化物,反应④是工业炼铁的原理;反应②是光合作用。
 (1)、化学式:G , 丙 .(2)、反应①、④的化学方程式:①;④(3)、甲一定含有的元素是 .(4)、Fe与蓝色溶液的反应属于反应(填基本反应类型)。
(1)、化学式:G , 丙 .(2)、反应①、④的化学方程式:①;④(3)、甲一定含有的元素是 .(4)、Fe与蓝色溶液的反应属于反应(填基本反应类型)。八、综合题
-
30. 金属及其化合物在生产生活中有广泛的应用。
 (1)、(一)金属的应用和防护
(1)、(一)金属的应用和防护用不锈钢、合成橡胶、氧化镁等材料制造的飞机轮胎属于材料。
(2)、航空煤油是飞机的燃料,它主要是由炼制的。(3)、铁易生锈,提出防止铁生锈的一种方法。(4)、特种钢中含有少量 。 和 粉混合在高温下反应可得到 ,该反应的化学方程式为 .(5)、 受热分解生成高熔点的 。 可用作阻燃剂,其主要原理是(选填序号)。a.分解吸热,降低可燃物着火点 b. 覆盖燃烧物,隔绝氧气
(6)、(二)制备还原性铁粉实验室利用废铁屑(含少量 )为原料制备还原性铁粉的流程如下:

粉可使“酸溶”产生的 转化为 ,该反应的化学方程式为 .
(7)、检验 已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加溶液,无明显现象。(8)、“干燥”时有少量 发生下列转化: ,该转化的化学方程式为 .(9)、“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是 .(10)、(三)测定还原性铁粉的组成还原性铁粉中含有少量 ,小组同学在老师的指导下进行以下实验。
资料:① 在加热时与 反应能生成相应氧化物。
② 不与酸反应。
实验1:取 样品,加入足量稀 ,充分反应后生成 。
实验2:另取 样品,按下图进行实验。

表:装置A和B的质量变化
装置
A
B
反应前
300.00
400.00
反应后
m
400.44
实验后A中固体全部变为红棕色,装置A、B的质量变化如上表。
装配好装置后,实验前先要
装置C的作用是
中, 。表中m的值是 .
反思:若用空气替代 进行实验,测得 的值偏小,可能的原因是。
-
-
-