安徽省宣城市2018-2019学年高考化学二模考试试卷
试卷更新日期:2019-08-26 类型:高考模拟
一、单选题
-
1. 化学与生活密切相关。下列说法中正确的是( )A、水泥、水玻璃、水晶均属于硅酸盐产品 B、防哂霜能够防止强紫外线引起皮肤中蛋白质的盐析 C、利用肥皂水处理蚊虫叮咬,主要是利用肥皂水的弱碱性 D、食品包装盒中的生石灰或铁粉,都可以起到抗氧化作用2. 设NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )A、0.1mol·L-1(NH4)2SO4溶液中NH4+数目一定小于0.2NA B、标况下,3.2gN2H4中含有的N-H键的数目为0.4NA C、将1 molCl2通入水中,溶液中HClO、Cl-、ClO-粒子数之和为2NA D、1mol的CO2和H2O(g)的混合气体与过量Na2O2充分反应转移的电子数为2NA3. 与甲、乙两套装置有关的下列说法正确的是( )
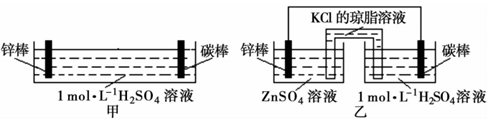 A、甲、乙装置中,锌棒均作负极,发生氧化反应 B、甲中锌棒直接与稀H2SO4接触,故甲生成气泡的速率更快 C、甲、乙装置的电解质溶液中,阳离子均向碳棒定向迁移 D、乙中盐桥设计的优点是迅速平衡电荷,提高电池效率4. 某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是( )
A、甲、乙装置中,锌棒均作负极,发生氧化反应 B、甲中锌棒直接与稀H2SO4接触,故甲生成气泡的速率更快 C、甲、乙装置的电解质溶液中,阳离子均向碳棒定向迁移 D、乙中盐桥设计的优点是迅速平衡电荷,提高电池效率4. 某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是( ) A、装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO42- B、实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒 C、三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气 D、装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气5. 多巴胺是一种神经传导物质,会传递兴奋及开心的信息。其部分合成路线如下,下列说法正确的是( )
A、装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO42- B、实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒 C、三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气 D、装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气5. 多巴胺是一种神经传导物质,会传递兴奋及开心的信息。其部分合成路线如下,下列说法正确的是( ) A、甲在苯环上的溴代产物有2种 B、1mol乙与H2发生加成,最多消耗3molH2 C、多巴胺分子中所有碳原子可能处在同一平面 D、甲、乙、多巴胺3种物质均属于芳香烃6. 短周期元素W、X、Y、Z、Q的原子序数依次增大,W的阴离子的核外电子数与氦相同。X的一种核素在考古时常用来鉴定一些文物的年代,Y在地壳中含量最多,Z原子半径为短周期中最大,Q存在由多原子分子构成的单质。下列说法错误的是( )A、W与X可形成3种以上化合物 B、W、X、Y只能形成1种二元酸 C、Y与Z可形成既含共价键又含离子键的化合物 D、X、Q的最高价氧化物对应水化物的酸性:Q>X7. t℃时,将0.200mol·L-1的某一元酸HA与0.200mol·L-1的NaOH溶液等体积混合,充分反应后所得溶液中部分离子浓度如下表。下列说法中正确的是( )
A、甲在苯环上的溴代产物有2种 B、1mol乙与H2发生加成,最多消耗3molH2 C、多巴胺分子中所有碳原子可能处在同一平面 D、甲、乙、多巴胺3种物质均属于芳香烃6. 短周期元素W、X、Y、Z、Q的原子序数依次增大,W的阴离子的核外电子数与氦相同。X的一种核素在考古时常用来鉴定一些文物的年代,Y在地壳中含量最多,Z原子半径为短周期中最大,Q存在由多原子分子构成的单质。下列说法错误的是( )A、W与X可形成3种以上化合物 B、W、X、Y只能形成1种二元酸 C、Y与Z可形成既含共价键又含离子键的化合物 D、X、Q的最高价氧化物对应水化物的酸性:Q>X7. t℃时,将0.200mol·L-1的某一元酸HA与0.200mol·L-1的NaOH溶液等体积混合,充分反应后所得溶液中部分离子浓度如下表。下列说法中正确的是( ) A、所得溶液中:c(Na+)>c(A-)>c(HA)>c(OH-) B、t℃时,水的离子积Kw=1.0×10-13 C、t℃时,一元酸HA的电离常数K=3.10×10-7 D、t℃时,0.100mol·L-1NaA溶液中A-的水解率为0.80%
A、所得溶液中:c(Na+)>c(A-)>c(HA)>c(OH-) B、t℃时,水的离子积Kw=1.0×10-13 C、t℃时,一元酸HA的电离常数K=3.10×10-7 D、t℃时,0.100mol·L-1NaA溶液中A-的水解率为0.80%二、实验题
-
8. 亚硝酸钠(NaNO2)是一种肉制品生产中常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组设计了如下图所示的装置制备NaNO2(A中加热装置已略去,NO可与过氧化钠粉末发生化合反应,也能被酸性KMnO4氧化成NO3-)。
 (1)、仪器a的名称是。(2)、A中实验现象为。(3)、为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是___________(填字母序号)。A、P2O5 B、无水CaCl2 C、碱石灰 D、浓硫酸(4)、E中发生反应的离子方程式为。(5)、从提高氮原子利用率的角度出发,其中B装置设计存在一定缺陷,如何改进?。(6)、已知:2NO2-+2I-+4H+=2NO↑+I2+2H2O;2S2O32-+I2=2I-+S4O62-
(1)、仪器a的名称是。(2)、A中实验现象为。(3)、为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是___________(填字母序号)。A、P2O5 B、无水CaCl2 C、碱石灰 D、浓硫酸(4)、E中发生反应的离子方程式为。(5)、从提高氮原子利用率的角度出发,其中B装置设计存在一定缺陷,如何改进?。(6)、已知:2NO2-+2I-+4H+=2NO↑+I2+2H2O;2S2O32-+I2=2I-+S4O62-为测定得到产品中NaNO2的纯度,采取如下实验步骤:准确称取质量为1.00g的NaNO2样品放入锥形瓶中,加适量水溶解后,加入过量的0.800mol·L-1KI溶液、淀粉溶液;然后滴加稀硫酸充分反应后,用0.500mol·L-1Na2S2O3溶液滴定至终点,读数,重复以上操作,3次所消耗Na2S2O3溶液的体积分别为20.02mL、19.98mL、20.25 mL。滴定终点时的实验现象 , 该样品中NaNO2纯度为(保留一位小数)。
三、综合题
-
9. 二氧化硫的催化氧化是工业上生产硫酸的主要反应,反应如下:(1)、I:2SO2(g)+O2(g) 2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
为研究该反应,某同学设计了以下三种已装固体V2O3催化剂的密闭容器装置

在初始体积与温度相同的条件下,甲、乙、丙中均按2 mol SO2、1molO2投料,达平衡时,三个容器中SO2的转化率从大到小的顺序为(用“甲、乙、丙”表示)。
(2)、在容器丙中,0.1MPa条件下,在不同温度或不同投料方式下研究上述反应得到数据如下表:
①表中:a=;b=。
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则Kp1=;Kp1Kp2(填“>”、“<”或“=”)。
③若按0.4 mol SO2、0.4molO2、0.4 mol SO3进行投料,则反应开始时v正(SO2)v逆(SO2)(填“>”、“<”或“=”)。
(3)、将上述固体催化剂V2O5换成NO2气体同样可以对该反应起到催化作用,此催化过程如下:Ⅱ:SO2(g)+NO2(g) SO3(g)+NO(g) △H2 K2(浓度平衡常数)
Ⅲ:2NO(g)+O2(g) 2NO2(g) △H3=-114.1kJ·mol-1 K3(浓度平衡常数)
△H2=;K3=(用含有K1、K2的表达式表示)。
10.(1)、Ⅰ.工业上常利用电解含有铁、钯、铜等金属的粗银棒精炼银,示意图如下:
阴极反应式为。
(2)、精炼过程中,AgNO3溶液的浓度将(填“增大”、“减小”或“不变”);原因是。(3)、Ⅱ.“钯(Pd)金”不仅是优异的催化剂,也是首饰界的新宠。精炼银的过程中钯元素可在电解液中大量富集,因此工业上常利用精炼银的电解液[主要成分为:AgNO3、Pd(NO3)2、Cu(NO3)2、Fe(NO3)3、Ni(NO3)2、HNO3等]为原料生产“钯金”,流程如下: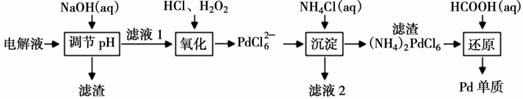
定量实验检测表明,当滤液1中c(Ni2+)=2×10-3mol·L-1时,Pd2+仍没有开始沉淀,计算此时溶液中c(Fe3+)= , (Ksp[Ni(OH)2]=2.0×10-15、Ksp[Fe(OH)3]=4.0×10-38)。
(4)、“氧化”过程中氧化剂与还原剂的物质的量之比为。(5)、为保证产品的纯净,“沉淀”过程中所得滤渣需要洗涤,简述检验滤渣是否洗净的实验方法。(6)、写出“还原”步骤中发生反应的离子方程式:。11. 硫及其化合物有许多用途。请回答下列问题。(1)、基态硫离子价层电子的轨道表达式为 , 其电子填充的最高能级的轨道数为。(2)、常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点由高到低的顺序依次为 , 原因是。(3)、方铅矿(即硫化铅)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)=H2[PbCl4]+H2S↑,则H2[PbCl4]中配位原子是 , 第一电离能I1(Cl)I1(S)(填“>”、“<”或¨=”),H2S中硫的杂化方式为 , 下列分子空间的构型与H2S相同的有。A.H2O B.SO3 C.O3 D.CH4
(4)、方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的空隙中。已知晶体密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 则晶胞中硫离子与铅离子最近的距离为nm。
四、推断题
-
12. 高分子聚合物Nomex芳纶(G)耐热性好、强度高,是一种很好的绝热材料和阻燃纤维,下图是 Nomex芳纶的合成路线图:
 (1)、A的名称为;④的反应类型为;G的结构简式为。(2)、写出反应②的化学方程式:。(3)、B的芳香族同分异构体H具有三种含氧官能团,其各自的特征反应如下:
(1)、A的名称为;④的反应类型为;G的结构简式为。(2)、写出反应②的化学方程式:。(3)、B的芳香族同分异构体H具有三种含氧官能团,其各自的特征反应如下:a.遇FeCl3溶液显紫色;b.可以发生水解反应;c.可发生银镜反应
符合以上性质特点的H共有种。
(4)、下列有关F的说法正确的是___________(填字母序号)。A、F的分子式为C14H12N2O3 B、F中只含有氨基和羧基两种官能团 C、F的核磁共振氢谱有11组吸收峰 D、F可以水解得到氨基酸(5)、聚氨基酸类物质以其无毒易降解特性广泛应用于药物载体,已知:CH3 CH2Cl+NH3 CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:。
-