安徽省合肥市2018-2019学年高考化学三模考试试卷
试卷更新日期:2019-08-26 类型:高考模拟
一、单选题
-
1. 化工生产与人类进步紧密相联。下列有关说法错误的是( )A、空气吹出法提取海水中溴通常使用SO2作还原剂 B、侯氏制碱法工艺流程中利用了物质溶解度的差异 C、合成氨采用高温、高压和催化剂主要是提高氢气平衡转化率 D、工业用乙烯直接氧化法制环氧乙烷体现绿色化学和原子经济2. 设NA为阿伏加德罗常数值。下列有关叙述错误的是( )A、常温常压下,1 mol氦气中含有的质子数为2NA B、l0g46%乙醇水溶液中所含氧原子数为0.4NA C、1 L1mol/LNa2CO3溶液中,阴离子总数小于NA D、浓硝酸热分解生成NO2、N2O4共23g,转移电子数为0.5NA3. 环丙叉环丙烷(n)由于其特殊的结构,一直受到结构和理论化学家的关注,它有如下转化关系。下列说法正确的是( )
 A、n分子中所有原子都在同一个平面上 B、n和:CBr2生成p的反应属于加成反应 C、p分子中极性键和非极性键数目之比为2:9 D、m分子同分异构体中属于芳香族化合物的共有四种4. 下列有关实验能达到相应实验目的的是( )
A、n分子中所有原子都在同一个平面上 B、n和:CBr2生成p的反应属于加成反应 C、p分子中极性键和非极性键数目之比为2:9 D、m分子同分异构体中属于芳香族化合物的共有四种4. 下列有关实验能达到相应实验目的的是( ) A、实验①用于实验室制备氯气 B、实验②用于制备干燥的氨气 C、实验③用于石油分馏制备汽油 D、实验④用于制备乙酸乙酯5. 如图所示的X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,下列说法正确的是( )
A、实验①用于实验室制备氯气 B、实验②用于制备干燥的氨气 C、实验③用于石油分馏制备汽油 D、实验④用于制备乙酸乙酯5. 如图所示的X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,下列说法正确的是( ) A、X、Y、W三种元素最低价氢化物的沸点依次升高 B、Z、X、W三种元素氧化物对应水化物的酸性依次增强 C、由X、W和氢三种元素形成的化合物中只含共价键 D、X、Z形成的二元化合物是一种新型无机非金属材料6. 下列有关电化学原理及应用的相关说法正确的是( )A、电池是能量高效转化装置,燃料电池放电时化学能全部转化为电能 B、电热水器用牺牲阳极的阴极保护法阻止不锈钢内胆腐蚀,阳极选用铜棒 C、工业上用电解法精炼铜过程中,阳极质量减少和阴极质量增加相同 D、电解氧化法在铝制品表面形成氧化膜减缓腐蚀,铝件作为阳极7. 25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法错误的是( )
A、X、Y、W三种元素最低价氢化物的沸点依次升高 B、Z、X、W三种元素氧化物对应水化物的酸性依次增强 C、由X、W和氢三种元素形成的化合物中只含共价键 D、X、Z形成的二元化合物是一种新型无机非金属材料6. 下列有关电化学原理及应用的相关说法正确的是( )A、电池是能量高效转化装置,燃料电池放电时化学能全部转化为电能 B、电热水器用牺牲阳极的阴极保护法阻止不锈钢内胆腐蚀,阳极选用铜棒 C、工业上用电解法精炼铜过程中,阳极质量减少和阴极质量增加相同 D、电解氧化法在铝制品表面形成氧化膜减缓腐蚀,铝件作为阳极7. 25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法错误的是( ) A、a点溶液中:c(H+)=6.0 10-3mol L-1 B、b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-) C、c点溶液中:c(OH-)=c(CH3COOH)+ c(H+) D、d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
A、a点溶液中:c(H+)=6.0 10-3mol L-1 B、b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-) C、c点溶液中:c(OH-)=c(CH3COOH)+ c(H+) D、d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)二、实验题
-
8. 乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288}易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。(1)、I.碳酸亚铁的制备(装置如下图所示)

仪器B的名称是;实验操作如下:打开kl、k2 , 加入适量稀硫酸,关闭kl , 使反应进行一段时间,其目的是。
(2)、接下来要使仪器C中的制备反应发生,需要进行的操作是 , 其反应的离子方程式为。(3)、仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是。(4)、Ⅱ.乳酸亚铁的制各及铁元素含量测定向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)、两位同学分别用不同的方案进行铁元素含量测定:①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是 。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液 , 即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24. 80 mL,则样品纯度为%(保留1位小数)。
三、工业流程
-
9. 某工厂以重晶石(主要含BaSO4)为原料,生产“电子陶瓷工业支柱”——钛酸(BaTiO3)的工艺流程如下:

回答下列问题:
(1)、为提高BaCO3的酸浸速率,可采取的措施为(写出一条即可);常温下,TiCl4为液体且易水解,配制一定浓度的TiCl4溶液的方法是 。(2)、用Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3 , 此反应的平衡常数K= (填写计算结果);若不考虑CO32-的水解,要使2. 33g BaSO4恰好完全转化为BaCO3 , 则至少需要浓度为1.0mol·L-1Na2CO3溶液 mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)(3)、流程中“混合”溶液的钛元素在不同pH时主要以TiO(OH)+、TiOC2O4、TiO(C2O4)22-三种形式存在(变化曲线如右图所示)。实际制备工艺中,先用氨水调节混合溶液的pH于2.8左右,再进行“沉淀”,其反应的离子方程式为;图中曲线c对应钛的形式为(填粒子符号)。 (4)、流程中“滤液”的主要成分为;隔绝空气煅烧草酸氧钛钡晶体得到钛酸钡粉体和气态产物,试写出反应的化学方程式:。
(4)、流程中“滤液”的主要成分为;隔绝空气煅烧草酸氧钛钡晶体得到钛酸钡粉体和气态产物,试写出反应的化学方程式:。四、综合题
-
10. 一定条件下,1molCH3OH与一定量O2发生反应时,生成CO、CO2或HCHO的能量变化如下图所示[反应物O2(g)和生成物H2O(g)已略去]。

回答下列问题:
(1)、在有催化剂作用下,CH3 OH与O2反应主要生成 (填“CO2、CO或HCHO”);计算:2HCHO(g)+O2(g)=2CO(g)+2H2O(g) =(2)、已知:CO(g)+2H2(g) CH3OH(g)①经测定不同温度下该反应的平衡常数如下:

该反应为 (填“放热”或“吸热”)反应;250℃时,某时刻测得该反应的反应物与生成物浓度为c(CO) =0.4mol/L、c(H2) =0. 4mol/L、c(CH3 OH) =0. 8mol/L,则此时υ(正)υ(逆)(填“>”、“=”或“<”)。
②某温度下,在体积固定的2L密闭容器中将1molCO和2molH2混合,使反应得到平衡,实验测得平衡时与起始时的气体压强比值为0 .7,则该反应的平衡常数为(保留l位小数)。
(3)、利用钠碱循环法可除去SO2。常温下,若吸收液吸收一定量SO2后的溶液中,n(SO32-):n(HSO3-) =3:2,则此时溶液呈(填“酸性”、“中性”或“碱性”)。(已知:H2SO3的电离常数为:Kal=l. 54×10-2、Ka2=l. 02×10-7)(4)、利用电化学法处理工业尾气SO2的装置如图所示,写出Pt(2)电极反应式:;当电路中转移0. 02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加 mol离子。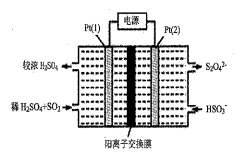 11. [化学—选修3:物质结构与性质]
11. [化学—选修3:物质结构与性质]含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)、基态B原子电子占据最高能级的电子云轮廓图为;基态Cu+的核外电子排布式为 。(2)、化合物(CH3)3N分子中N原子杂化方式为 , 该物质能溶于水的原因是 。(3)、PH3分子的键角小于NH3分子的原因是 ;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式 为。(4)、磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示: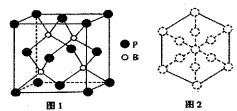
①在一个晶胞中磷原子的配位数为。
②已知磷化硼晶体的密度为ρg/cm3 , 阿伏加德罗常数为NA , 则B-P键长为pm。
③磷化硼晶胞沿着体对角线方向的投影如图2,请在答题卡上将表示B原子的圆圈涂黑。
12. 有机物F是合成药物“银屑灵”的中间体,其合成流程如下:
回答下列问题:
(1)、化合物A的名称为 , 化合物C中含氧官能团结构简式为。(2)、写出A→B的化学方程式:。(3)、D→E的反应类型为 , F的分子式为。(4)、写出同时满足下列条件的C的一种同分异构体的结构简式:。①能发生银镜反应
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应
③分子中核磁共振氢谱为四组峰
(5)、设计以甲苯、乙醛为起始原料(其它试剂任选),制备 的合成路线流程图:
的合成路线流程图:
-
-