安徽省滁州市定远县西片区2018-2019学年高一上学期化学期中考试试卷
试卷更新日期:2019-08-20 类型:期中考试
一、单选题
-
1. 金属材料的开发一直是材料科学的研究热点,一些新的金属材料相继被开发出来并应用于工农业生产和高科技领域。例如,铀(U)用作核电厂反应堆的核燃料,镅(Am)在烟雾探测器中用作烟雾监测材料;特点是被誉为“21世纪的金属”——钛(Ti),应用前景更为广阔。钛(titanium)是一种活泼金属,但因其表面容易形成致密的氧化物保护膜使它不易跟其他物质反应,而具有一定的抗腐蚀能力。除此之外,它还具有熔点高、硬度大、可塑性强、密度小等优点。根据以上背景资料及所学知识,你认为下列说法中错误的是( )A、钛不属于稀土金属 B、钛是很好的航天航空材料 C、钛在空气中不与其他物质反应 D、钛有较好的抗腐蚀能力,是很好的防腐材料2. 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、含有NA个原子的氢气在标准状况下的体积约为22.4 L B、25 ℃,1.01×105Pa,64 g SO2中含有的原子数为3NA C、40 g NaOH溶解在1 L水中,则其100 mL溶液中含Na+数为0.1NA D、标准状况下,11.2 L H2O含有的分子数为0.5NA3. 下列盛放试剂的方法正确的是( )A、浓硝酸易挥发,应贮存于磨口细口瓶中,加盖橡胶塞,并放置于阴凉处 B、汽油或煤油存放在带橡胶塞的棕色玻璃瓶中 C、碳酸钠溶液或氢氧化钙溶液存放在配有磨口塞的棕色玻璃瓶中 D、硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中4. 粗盐溶液过滤,除去泥沙后的滤液中,含有可溶性的氯化钙、氯化镁、硫酸钠等杂质,通过如下几个实验步骤,可将上述杂质除去:
①加入稍过量的碳酸钠溶液;②加入稍过量的氢氧化钠溶液;③加入稍过量的氯化钡溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是( )
A、③②①⑤④ B、①②③⑤④ C、②③①④⑤ D、③⑤②①④5. 下列叙述中正确的是( )A、检验稀盐酸和氢氧化钠溶液是否恰好完全反应,可在反应后溶液中滴加无色酚酞溶液,无明显现象,恰好完全反应 B、某液体可能是海水或蒸馏水,将其蒸发结晶,液体消失,无残留物,该液体为蒸馏水 C、检验溶液中是否含硫酸根离子,蒸发结晶液体消失,无残留物,溶液中一定含硫酸根离子 D、某溶液中加入稀盐酸有气泡产生,该溶液中一定含碳酸根离子6. 海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是( ) A、步骤④的操作是过滤 B、可用淀粉溶液检验步骤②的反应是否进行完全 C、步骤①、③的操作分别是过滤、萃取 D、步骤③中加入的有机溶剂可能是酒精或四氯化碳7. 三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是( )A、原子数目相等的三种气体,质量最大的是Z B、相同条件下,同质量的三种气体,气体密度最小的是X C、若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol D、同温下,体积相同的两容器分别充入2 g Y气体和1 g Z气体,则其压强比为2∶18. 3.6 g碳在一定量的氧气中燃烧,反应后生成一氧化碳和二氧化碳混合气体的平均摩尔质量 是32 g·mol-1 , 则生成的一氧化碳的质量是( )A、3.3 g B、6.3 g C、8.4 g D、13.2 g9. 将质量均为m g的O2、X、Y气体分别充入相同容积的密闭容器中,压强(p)与温度(T)的关系如图所示,则X、Y气体可能分别是( )
A、步骤④的操作是过滤 B、可用淀粉溶液检验步骤②的反应是否进行完全 C、步骤①、③的操作分别是过滤、萃取 D、步骤③中加入的有机溶剂可能是酒精或四氯化碳7. 三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是( )A、原子数目相等的三种气体,质量最大的是Z B、相同条件下,同质量的三种气体,气体密度最小的是X C、若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol D、同温下,体积相同的两容器分别充入2 g Y气体和1 g Z气体,则其压强比为2∶18. 3.6 g碳在一定量的氧气中燃烧,反应后生成一氧化碳和二氧化碳混合气体的平均摩尔质量 是32 g·mol-1 , 则生成的一氧化碳的质量是( )A、3.3 g B、6.3 g C、8.4 g D、13.2 g9. 将质量均为m g的O2、X、Y气体分别充入相同容积的密闭容器中,压强(p)与温度(T)的关系如图所示,则X、Y气体可能分别是( ) A、C2H4、CH4 B、CO2、Cl2 C、SO2、CO2 D、CH4、Cl210. 配制100 mL 1.0 mol·L-1的碳酸钠溶液,下列情况会导致溶液浓度偏高的是( )A、容量瓶使用前用1.0 mol·L-1的碳酸钠溶液润洗 B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 C、仰视确定凹液面与刻度线相切 D、用敞口容器称量碳酸钠且时间过长11. 某温度下,VmL不饱和NaNO3溶液ag,蒸发掉bg水或加入bg NaNO3固体(恢复到原温度)均可使溶液达到饱和,则下列量的计算结果正确的是( )A、该温度下NaNO3的溶解度为100 g B、原不饱和溶液中NaNO3质量分数为 % C、原不饱和溶液中NaNO3物质的量浓度为 mol·L-1 D、原不饱和溶液的密度为 g·mL-112. 把500 有 和 的混合溶液分成5等份,取一份加入含 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )A、 B、 C、 D、13. 下列关于氧化物分类的说法错误的组合为( )
A、C2H4、CH4 B、CO2、Cl2 C、SO2、CO2 D、CH4、Cl210. 配制100 mL 1.0 mol·L-1的碳酸钠溶液,下列情况会导致溶液浓度偏高的是( )A、容量瓶使用前用1.0 mol·L-1的碳酸钠溶液润洗 B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 C、仰视确定凹液面与刻度线相切 D、用敞口容器称量碳酸钠且时间过长11. 某温度下,VmL不饱和NaNO3溶液ag,蒸发掉bg水或加入bg NaNO3固体(恢复到原温度)均可使溶液达到饱和,则下列量的计算结果正确的是( )A、该温度下NaNO3的溶解度为100 g B、原不饱和溶液中NaNO3质量分数为 % C、原不饱和溶液中NaNO3物质的量浓度为 mol·L-1 D、原不饱和溶液的密度为 g·mL-112. 把500 有 和 的混合溶液分成5等份,取一份加入含 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )A、 B、 C、 D、13. 下列关于氧化物分类的说法错误的组合为( )①金属氧化物也可以是酸性氧化物;②非金属氧化物一定是酸性氧化物;③碱性氧化物一定是金属氧化物;④能与酸反应生成盐和水的氧化物一定是碱性氧化物;⑤能与碱反应生成盐和水的氧化物一定是酸性氧化物
A、③④⑤ B、①②③ C、②④⑤ D、①②③④⑤14. 下列各组离子在水溶液中一定能大量共存的是( )A、含有大量 Ba2+的溶液中:Cl- K+ B、含有大量H+的溶液中:Mg2+ Na+ C、含有大量OH-的溶液中:Mg2+ D、含有大量Na+的溶液中:H+ K+15. 如图所示,广口瓶中盛有气体X,胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入瓶中,振荡,一段时间后可见小球a膨胀鼓起。下表中的各组物质不出现上述现象的是( ) A、X为一氧化碳、Y为氢氧化钙溶液 B、X为二氧化碳、Y为氢氧化钠溶液 C、X为氯化氢、Y为氢氧化钡溶液 D、X为二氧化硫、Y为氢氧化钠溶液16. 有关胶体等分散系的制备、性质的相关说法错误的是( )A、向沸水中逐滴加入氯化铁饱和溶液,继续煮沸至液体呈红褐色,即制得氢氧化铁胶体 B、向氢氧化铁胶体中加入稀硫酸至过量,现象为先生成红褐色沉淀,之后沉淀溶解 C、依据丁达尔效应可将分散系分为溶液、胶体与浊液 D、将氢氧化铁胶体与硅酸溶胶相互混合,混合液变浑浊17. 上海建成了我国第一条磁悬浮铁路。磁悬浮的核心技术是利用超导体的反磁性。高温超导物质(Y2Ba4Cu6O13)是以YmOn、BaO和CuO为原料,经研磨烧结而成,此过程中所有元素的化合价均不变,则高温超导物质(Y2Ba4Cu6O13)中Y元素的化合价是( )A、+2 B、+3 C、+4 D、+518. 下列反应的离子方程式正确的是( )A、Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+ CO32-+ H2O B、等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O C、向100mL 1mol/L FeBr2溶液中通入0. 5mol Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- D、氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+ 3H+=Fe3++ 3H2O19. 对于反应3Cl2+6NaOH 5NaCl+NaClO3+3H2O,以下叙述正确的是( )A、Cl2是氧化剂,NaOH是还原剂 B、被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1 C、Cl2既做氧化剂又做还原剂 D、氧化剂得电子数与还原剂失电子数之比为5∶120. 常温下,在溶液中能发生如下反应:①2A2++B2=2A3++2B﹣;②16H++10Z﹣+2XO4-=2X2++5Z2+8H2O;③2B﹣+Z2=B2+2Z﹣ , 由此判断下列说法错误的是( )A、Z2+2A2+=2A3++2Z﹣反应可以进行 B、Z元素在②③反应中均被还原 C、氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ D、还原性由强到弱顺序是A2+、B﹣、Z﹣、X2+21. 用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )
A、X为一氧化碳、Y为氢氧化钙溶液 B、X为二氧化碳、Y为氢氧化钠溶液 C、X为氯化氢、Y为氢氧化钡溶液 D、X为二氧化硫、Y为氢氧化钠溶液16. 有关胶体等分散系的制备、性质的相关说法错误的是( )A、向沸水中逐滴加入氯化铁饱和溶液,继续煮沸至液体呈红褐色,即制得氢氧化铁胶体 B、向氢氧化铁胶体中加入稀硫酸至过量,现象为先生成红褐色沉淀,之后沉淀溶解 C、依据丁达尔效应可将分散系分为溶液、胶体与浊液 D、将氢氧化铁胶体与硅酸溶胶相互混合,混合液变浑浊17. 上海建成了我国第一条磁悬浮铁路。磁悬浮的核心技术是利用超导体的反磁性。高温超导物质(Y2Ba4Cu6O13)是以YmOn、BaO和CuO为原料,经研磨烧结而成,此过程中所有元素的化合价均不变,则高温超导物质(Y2Ba4Cu6O13)中Y元素的化合价是( )A、+2 B、+3 C、+4 D、+518. 下列反应的离子方程式正确的是( )A、Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+ CO32-+ H2O B、等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O C、向100mL 1mol/L FeBr2溶液中通入0. 5mol Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- D、氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+ 3H+=Fe3++ 3H2O19. 对于反应3Cl2+6NaOH 5NaCl+NaClO3+3H2O,以下叙述正确的是( )A、Cl2是氧化剂,NaOH是还原剂 B、被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1 C、Cl2既做氧化剂又做还原剂 D、氧化剂得电子数与还原剂失电子数之比为5∶120. 常温下,在溶液中能发生如下反应:①2A2++B2=2A3++2B﹣;②16H++10Z﹣+2XO4-=2X2++5Z2+8H2O;③2B﹣+Z2=B2+2Z﹣ , 由此判断下列说法错误的是( )A、Z2+2A2+=2A3++2Z﹣反应可以进行 B、Z元素在②③反应中均被还原 C、氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ D、还原性由强到弱顺序是A2+、B﹣、Z﹣、X2+21. 用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( ) A、实验中发生的反应都是氧化还原反应 B、铝是一种较活泼的金属 C、铝与氧气反应放出大量的热量 D、铝片上生成的白毛是氧化铝和氧化汞的混合物22. 为了配制 100 个水分子含有 1 个钠离子的溶液,90.9 g 水中需要投入钠的质量是A、4.6 g B、2.3 g C、1.161 5 g D、1.15 g23. 装置甲、乙、丙都是铁与水蒸气反应的实验装置
A、实验中发生的反应都是氧化还原反应 B、铝是一种较活泼的金属 C、铝与氧气反应放出大量的热量 D、铝片上生成的白毛是氧化铝和氧化汞的混合物22. 为了配制 100 个水分子含有 1 个钠离子的溶液,90.9 g 水中需要投入钠的质量是A、4.6 g B、2.3 g C、1.161 5 g D、1.15 g23. 装置甲、乙、丙都是铁与水蒸气反应的实验装置

下列说法错误的是( )
A、甲装置中氯化钙的作用是除去氢气中混有的水蒸气 B、选用丙装置,实验结束时先移去酒精灯,再将导气管拿出水面 C、用乙装置实验时,蒸发皿中产生大量肥皂泡,点燃肥皂泡发出爆鸣声 D、三个装置相比较,乙装置简单、操作简便、节约原料、安全性好24. 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )
选项
W
X
A
盐酸
碳酸钠溶液
B
氢氧化钠溶液
氯化铝溶液
C
二氧化碳
氢氧化钙溶液
D
氯气
铁单质
A、A B、B C、C D、D二、实验题
-
25. 某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:

请回答下列问题:
(1)、A中反应的离子方程式是。(2)、实验操作Ⅱ吹入热空气的目的是。(3)、装置C的作用是 , C中盛放的药品是。(4)、实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式。(5)、由上述实验得出的结论是。(6)、实验反思:①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):。
26. 实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:(1)、配制溶液时,一般可以分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为。必须用到的玻璃仪器有烧杯、胶头滴管、。
(2)、某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为g,要完成本实验该同学应称出g NaOH。 (3)、如图是该同学转移溶液的示意图,图中有两处错误,请写出:
(3)、如图是该同学转移溶液的示意图,图中有两处错误,请写出:
①。
②。
(4)、在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________(填字母)。A、所用NaOH已经潮解 B、向容量瓶中加水未到刻度线 C、有少量NaOH溶液残留在烧杯里 D、用带游码的托盘天平称5.4 g NaOH(1 g以下用游码)时误用了“左码右物”方法27. 某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题: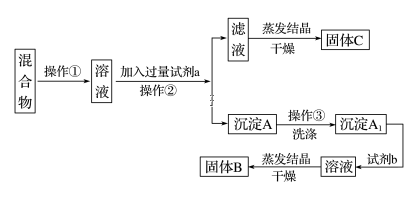
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)、操作①的名称是 , 操作②的名称是。(2)、试剂a是(填化学式,下同),试剂b是 , 固体B是。(3)、加入试剂a所发生反应的化学方程式为。加入试剂b所发生反应的化学方程式为。
(4)、该方案能否达到实验目的:(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)。(5)、若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是的质量。28. 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。(1)、某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。(2)、该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
①A中发生反应离子方程式为。
②将仪器连接好以后,必须进行的第一步操作是。
③B装置出来的气体是否需要干燥。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式 , 。
⑤D中NaOH溶液的作用。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是。
a.直接读取气体体积,不需冷却到室温
B.上下移动量筒,使得E、F中液面高度相同
C.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果。(填“偏大”、“偏小”或“不影响”)