人教版化学高二选修4第四章第四节金属的电化学腐蚀与防护同步练习
试卷更新日期:2015-12-31 类型:同步测试
一、选择题
-
1.
如图,向还原铁粉中加入少量的炭粉,混合均匀后,撒入内壁用NaCl溶液润湿过的具支试管中,塞紧橡皮塞.几分钟后,打开止水夹,观察到导管中水柱上升.对此过程所作的分析正确的是( )
 A、碳粉在电化学腐蚀过程中作负极 B、炭粉被氧化 C、发生了吸氧腐蚀 D、发生了析氢腐蚀2.
A、碳粉在电化学腐蚀过程中作负极 B、炭粉被氧化 C、发生了吸氧腐蚀 D、发生了析氢腐蚀2.利用如图装置可以模拟铁的电化学防护.下列说法不正确的是( )
 A、若X为锌棒,开关K置于M处,可减缓铁的腐蚀 B、若X为锌棒,开关K置于M处,铁极发生氧化反应 C、若X为碳棒,开关K置于N处,可减缓铁的腐蚀 D、若X为碳棒,开关K置于N处,X极发生氧化反应3. 下列叙述错误的是( )A、生铁中含有碳,抗腐蚀能力比纯铁弱 B、用锡焊接的铁质器件,焊接处易生锈 C、铁管上镶嵌锌块,铁管不易被腐蚀 D、在铁制品上镀铜时,镀件为阳极,铜盐为电镀液4. 下列金属防腐的措施中,使用外加电流的阴极保护法的是( )A、水中的钢闸门连接电源的负极 B、金属护拦表面涂漆 C、枪炮表面涂上一层油 D、地下钢管连接镁块5.
A、若X为锌棒,开关K置于M处,可减缓铁的腐蚀 B、若X为锌棒,开关K置于M处,铁极发生氧化反应 C、若X为碳棒,开关K置于N处,可减缓铁的腐蚀 D、若X为碳棒,开关K置于N处,X极发生氧化反应3. 下列叙述错误的是( )A、生铁中含有碳,抗腐蚀能力比纯铁弱 B、用锡焊接的铁质器件,焊接处易生锈 C、铁管上镶嵌锌块,铁管不易被腐蚀 D、在铁制品上镀铜时,镀件为阳极,铜盐为电镀液4. 下列金属防腐的措施中,使用外加电流的阴极保护法的是( )A、水中的钢闸门连接电源的负极 B、金属护拦表面涂漆 C、枪炮表面涂上一层油 D、地下钢管连接镁块5.如图所示的方案可以降低铁闸门的腐蚀速率.下列判断正确的是( )
 A、若X为导线,Y可以是锌 B、若X为导线,铁闸门上的电极反应式为Fe﹣2e→Fe2+ C、若X为直流电源,铁闸门做负极 D、若X为直流电源,Y极上发生还原反应6. 将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )
A、若X为导线,Y可以是锌 B、若X为导线,铁闸门上的电极反应式为Fe﹣2e→Fe2+ C、若X为直流电源,铁闸门做负极 D、若X为直流电源,Y极上发生还原反应6. 将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( ) A、铁棒AB段发生反应为O2+4e﹣+2H2O=4OH﹣ B、腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段 C、向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 D、产生这种现象的本质原因是铁棒所处的化学环境不同7. 相同材质的铁在图中的四种情况下腐蚀最快的是( )A、
A、铁棒AB段发生反应为O2+4e﹣+2H2O=4OH﹣ B、腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段 C、向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 D、产生这种现象的本质原因是铁棒所处的化学环境不同7. 相同材质的铁在图中的四种情况下腐蚀最快的是( )A、 B、
B、 C、
C、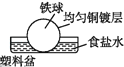 D、
D、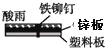 8. 为了使埋在地下的钢管不易生锈,设计了如下几种方案,将钢管:①用导线与铅板连接 ②用导线与锌板连接 ③用导线与碳棒连接 ④与直流电源负极连接 ⑤直流电源正极连接,其中可采取的方法是( )A、①④ B、②④ C、②③ D、①⑤9. 铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,正确的是( )
8. 为了使埋在地下的钢管不易生锈,设计了如下几种方案,将钢管:①用导线与铅板连接 ②用导线与锌板连接 ③用导线与碳棒连接 ④与直流电源负极连接 ⑤直流电源正极连接,其中可采取的方法是( )A、①④ B、②④ C、②③ D、①⑤9. 铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,正确的是( )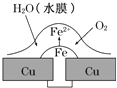 A、此过程中铜被腐蚀 B、此过程中电子从Fe移向Cu C、正极电极反应式为:2H++2e﹣═H2↑ D、铁钉表面发生的反应为Fe﹣3e﹣═Fe3+10.
A、此过程中铜被腐蚀 B、此过程中电子从Fe移向Cu C、正极电极反应式为:2H++2e﹣═H2↑ D、铁钉表面发生的反应为Fe﹣3e﹣═Fe3+10.已知:金属铁(含杂质碳)在酸性溶液中发生析氢腐蚀,总反应方程式为:Fe+2H+═Fe2++H2↑;铁在中性或碱性溶液中发生吸氧腐蚀,总反应式为:4Fe+3O2+6H2O═4Fe(OH)3↓.某课外活动小组,将剪下的一块铁片放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )
 A、铁被腐蚀 B、B中导气管里形成一段水柱 C、金属片剪口处变红 D、B中导气管中产生气泡11.
A、铁被腐蚀 B、B中导气管里形成一段水柱 C、金属片剪口处变红 D、B中导气管中产生气泡11.利用如图装置,其中不能实现铁的电化学防护的一组是( )
 A、X为锌,开关K置于M处 B、X为锌,开关K置于N处 C、X为铜,开关K置于M处 D、X为碳棒,开关K置于N处12.
A、X为锌,开关K置于M处 B、X为锌,开关K置于N处 C、X为铜,开关K置于M处 D、X为碳棒,开关K置于N处12.如图是模拟铁的电化学防护装置.以下叙述正确的是( )
 A、此装置属于电解池 B、此装置中的铁极上发生氧化反应 C、该电化学防护法称为“牺牲阳极阴极保护法” D、该电化学防护法称为“外加电源阴极保护法”13. 钢铁生锈过程发生如下反应:
A、此装置属于电解池 B、此装置中的铁极上发生氧化反应 C、该电化学防护法称为“牺牲阳极阴极保护法” D、该电化学防护法称为“外加电源阴极保护法”13. 钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O.
下列说法正确的是( )
A、反应①、②中电子转移数目相等 B、反应①中氧化剂是氧气和水 C、与铜质水龙头连接处的钢质水管不易发生腐蚀 D、钢铁在潮湿的空气中不能发生电化学腐蚀14. 如图水槽中盛装的是海水,其中铁被腐蚀最慢的是( )A、 B、
B、 C、
C、 D、
D、 15. 金属腐蚀造成的损失非常严重,金属腐蚀可分为化学腐蚀和电化学腐蚀.下列现象不能用电化学腐蚀来解释的是( )A、铜板上的铁铆钉在阴雨天易生锈 B、马口铁(镀锡的铁)破损后很快生锈 C、铜器皿在高温环境中迅速变黑 D、电工作业中若将铜、铝导线直接相连易出现接触不良现象16. 下列有关金属腐蚀与防护的说法中正确的是( )A、电化学腐蚀要比化学腐蚀普遍的多,但腐蚀速度要比化学腐蚀慢得多 B、当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 C、海轮外壳连接锌块是采用牺牲阳极的阴极保护法保护外壳不受腐蚀 D、地下输油钢管与外加直流电源的正极相连可保护其不受腐蚀17.
15. 金属腐蚀造成的损失非常严重,金属腐蚀可分为化学腐蚀和电化学腐蚀.下列现象不能用电化学腐蚀来解释的是( )A、铜板上的铁铆钉在阴雨天易生锈 B、马口铁(镀锡的铁)破损后很快生锈 C、铜器皿在高温环境中迅速变黑 D、电工作业中若将铜、铝导线直接相连易出现接触不良现象16. 下列有关金属腐蚀与防护的说法中正确的是( )A、电化学腐蚀要比化学腐蚀普遍的多,但腐蚀速度要比化学腐蚀慢得多 B、当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 C、海轮外壳连接锌块是采用牺牲阳极的阴极保护法保护外壳不受腐蚀 D、地下输油钢管与外加直流电源的正极相连可保护其不受腐蚀17.为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里保存一星期后,下列对实验结束时现象描述不正确的是( )
 A、装置Ⅰ左侧的液面一定会上升 B、左侧液面装置Ⅰ比装置Ⅱ的低 C、装置Ⅱ中的铁钉腐蚀最严重 D、装置Ⅲ中的铁钉几乎没被腐蚀18. 玉溪市聂耳公园的聂耳铜像,满身都是铜绿,从单纯避免其起铜绿的角度讲,下列方法可行的是( )A、将铜像放置在一个银质底座上 B、经常用水清洗铜像 C、在铜像适当的位置上钉上一块锌片,并定期进行补充或更换 D、定期用酸清洗铜像19. “轻轨电车”是近年来又一新兴的交通工具,具有无污染的优点.轻轨电车运行中,在轻轨电车跟架空电线的接触点上,由于高速摩擦会产生高温,因此接触点的材料应具有耐高温、不易氧化、能导电的性质.你认为最合适选作接触点的是( )A、金刚石 B、石墨 C、铝 D、铜20. 下列关于金属腐蚀的叙述正确的是( )A、本质是:M+nH2O=M(OH)n+ H2↑ B、电化学腐蚀必须在酸性条件下进行 C、化学腐蚀比电化学腐蚀更普遍 D、本质是:M﹣ne﹣=Mn+
A、装置Ⅰ左侧的液面一定会上升 B、左侧液面装置Ⅰ比装置Ⅱ的低 C、装置Ⅱ中的铁钉腐蚀最严重 D、装置Ⅲ中的铁钉几乎没被腐蚀18. 玉溪市聂耳公园的聂耳铜像,满身都是铜绿,从单纯避免其起铜绿的角度讲,下列方法可行的是( )A、将铜像放置在一个银质底座上 B、经常用水清洗铜像 C、在铜像适当的位置上钉上一块锌片,并定期进行补充或更换 D、定期用酸清洗铜像19. “轻轨电车”是近年来又一新兴的交通工具,具有无污染的优点.轻轨电车运行中,在轻轨电车跟架空电线的接触点上,由于高速摩擦会产生高温,因此接触点的材料应具有耐高温、不易氧化、能导电的性质.你认为最合适选作接触点的是( )A、金刚石 B、石墨 C、铝 D、铜20. 下列关于金属腐蚀的叙述正确的是( )A、本质是:M+nH2O=M(OH)n+ H2↑ B、电化学腐蚀必须在酸性条件下进行 C、化学腐蚀比电化学腐蚀更普遍 D、本质是:M﹣ne﹣=Mn+二、非选择题
-
21. 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.请回答钢铁在腐蚀、防护过程中的有关问题.(1)、钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程的电极反应式为:负极 , 正极 .(2)、
下列哪个装置可防止铁棒被腐蚀 .



 (3)、如果镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因22.
(3)、如果镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因22.钢铁工业是国家工业的基础,钢铁生锈现象却随处可见,为此每年国家损失大量资金.请回答钢铁腐蚀与防护过程中的有关问题.

 (1)、钢铁的电化学腐蚀原理,在酸性环境中发生析氢腐蚀,在中性或碱性环境中发生吸氧腐蚀.
(1)、钢铁的电化学腐蚀原理,在酸性环境中发生析氢腐蚀,在中性或碱性环境中发生吸氧腐蚀.①分别写出图1中铁电极和石墨电极的电极反应式: .
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在图1虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向.
③写出修改后石墨电极的电极反应式 .
(2)、工业上常用盐酸除去铁锈.现将一生锈的铁片放入盐酸中,溶液中可能发生的化学反应的化学方程式有 .(3)、在实际生产中,可在铁制品的表面镀铜防止铁被腐蚀.装置示意如图2:①A电极对应的金属是(写元素名称) , B电极的电极反应式是;
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为mol.
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 .
23.如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象:
 (1)、若试管内液面上升,则溶液呈性,电极反应式为:正极(2)、若试管内液面下降,则溶液呈性,电极反应式为:正极 .24.
(1)、若试管内液面上升,则溶液呈性,电极反应式为:正极(2)、若试管内液面下降,则溶液呈性,电极反应式为:正极 .24.如图所示为某研究性学习小组探究金属腐蚀条件的实验装置图,试分析实验并回答下列问题:

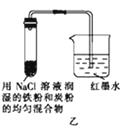
 (1)、起始时若甲、乙、丙三套装置的导管中液面高度相同,则过一段时间后导管中液面最高的是(填装置代号).(2)、通过甲、乙装置的对比实验说明,钢铁中碳的含量越(填“高”或“低”)越容易被腐蚀.(3)、乙装置中发生电化学腐蚀时正极的电极反应式为 .(4)、为防止铁的锈蚀,工业上普遍采用的方法是(写出一点即可).25. 回答下列问题:(1)、金属腐蚀一般可分为化学腐蚀和 腐蚀.(2)、炒过菜的铁锅未及时洗净容易发生腐蚀.
(1)、起始时若甲、乙、丙三套装置的导管中液面高度相同,则过一段时间后导管中液面最高的是(填装置代号).(2)、通过甲、乙装置的对比实验说明,钢铁中碳的含量越(填“高”或“低”)越容易被腐蚀.(3)、乙装置中发生电化学腐蚀时正极的电极反应式为 .(4)、为防止铁的锈蚀,工业上普遍采用的方法是(写出一点即可).25. 回答下列问题:(1)、金属腐蚀一般可分为化学腐蚀和 腐蚀.(2)、炒过菜的铁锅未及时洗净容易发生腐蚀.①若铁锅内残液呈酸性,则腐蚀主要属于 (填“吸氧”或“析氢”,下同)腐蚀;若残液中主要含有NaCl,腐蚀应主要属于 腐蚀.
②吸氧腐蚀中,负极的电极反应式为 .铁锈中铁的化合价为 .
(3)、如果在铁的表面镀上一层铜,就可以防止铁生锈,则在电镀过程中铁为 极,电极反应式为 ,铜为 极,电极反应式为 .