浙江省宁波市象山县丹城二中2018-2019学年九年级上学期科学第一次月考试卷
试卷更新日期:2019-08-14 类型:月考试卷
一、选择题(本题共15小题,第1~10小题每题4分,第11~15小题每题3分,共55分。请选出一个符合题意的选项,不选、多选、错选均不给分)
-
1. 某同学制作的试剂标签如下,其中化学式书写不正确的是( )A、
 B、
B、 C、
C、 D、
D、 2. 下列数据为常见水果的近似pH,其中呈碱性的水果是( )A、菠萝 pH=5.1 B、草莓 pH=3.1 C、苹果 pH=4.7 D、柿子 pH=8.33. 化学方程式:2N2H4+X=3N2+ 4H2O是发射通讯卫星的火箭发生的化学反应。X的化学式是( )A、NO2 B、N2O C、N2O3 D、N2O44. 下列各组物质中,俗名、化学名称和化学式表示的是同一种物质的是( )
2. 下列数据为常见水果的近似pH,其中呈碱性的水果是( )A、菠萝 pH=5.1 B、草莓 pH=3.1 C、苹果 pH=4.7 D、柿子 pH=8.33. 化学方程式:2N2H4+X=3N2+ 4H2O是发射通讯卫星的火箭发生的化学反应。X的化学式是( )A、NO2 B、N2O C、N2O3 D、N2O44. 下列各组物质中,俗名、化学名称和化学式表示的是同一种物质的是( )
A、烧碱、氧化钠、Na2O B、纯碱、氢氧化钠、NaOH C、石灰石、碳酸钙、CaCO3 D、熟石灰、氧化钙、CaO5. 实验操作有误或不规范,很可能造成实验失败甚至酿成事故。下列实验操作正确的是( )A、存放氧气 B、稀释浓硫酸
B、稀释浓硫酸  C、测定空气中氧气含量
C、测定空气中氧气含量  D、称量氢氧化钠
D、称量氢氧化钠  6. 如图是物质甲和乙反应生成丙的微观示意图,下列说法正确的是( )
6. 如图是物质甲和乙反应生成丙的微观示意图,下列说法正确的是( ) A、该化学反应属于化合反应 B、甲和乙属于单质,丙属于化合物 C、参加反应的甲与乙的分子个数比为1:1 D、1个丙分子由1个甲分子和2个乙分子构成7. 对于化学反应方程式2H2+O2 2H2O表示的意义,叙述错误的是( )A、在点燃的条件下,氢气和氧气反应生成水 B、这属于化合反应 C、每2份质量的氢气和1份质量的氧气完全反应能生成2份质量的水 D、H2、O2、H2O的粒子个数比为2:1:28. 将一定量的浓硫酸和浓盐酸分别敞口放置在空气中一段时间后,下列说法正确的是( )A、溶液的质量都增加 B、溶液的质量都减少 C、溶液的溶质质量分数都减小 D、溶液的溶质质量分数都增大9. 化学概念在逻辑上存在如图所示关系时,对下列概念间的关系说法正确的是( )
A、该化学反应属于化合反应 B、甲和乙属于单质,丙属于化合物 C、参加反应的甲与乙的分子个数比为1:1 D、1个丙分子由1个甲分子和2个乙分子构成7. 对于化学反应方程式2H2+O2 2H2O表示的意义,叙述错误的是( )A、在点燃的条件下,氢气和氧气反应生成水 B、这属于化合反应 C、每2份质量的氢气和1份质量的氧气完全反应能生成2份质量的水 D、H2、O2、H2O的粒子个数比为2:1:28. 将一定量的浓硫酸和浓盐酸分别敞口放置在空气中一段时间后,下列说法正确的是( )A、溶液的质量都增加 B、溶液的质量都减少 C、溶液的溶质质量分数都减小 D、溶液的溶质质量分数都增大9. 化学概念在逻辑上存在如图所示关系时,对下列概念间的关系说法正确的是( )
①纯净物与混合物属于包含关系
②化合物与氧化物属于包含关系
③单质与化合物属于交叉关系
④金属元素与非金属元素属于并列关系
⑤原子与电子属于并列关系.
A、②④ B、③④ C、①⑤ D、①②10. 一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是( )物质
甲
乙
丙
丁
反应前的质量/g
50
0.5
0
0
反应后的质量/g
23
X
24
3
A、x的值等于0.5 B、甲一定是化合物 C、丙和丁的质量变化比为8:1 D、该反应是化合反应11. 下列各组离子在溶液中能大量共存的是( )A、Ca2+ Cl− Na+ B、Cu2+ K+ OH− C、H+ Na+ D、K+ Na+12. 如图所示,当胶头滴管中的液体滴入到锥形瓶中时,会引起气球膨胀的是( )
选项
A
B
C
D
锥形瓶
MnO2
Zn
H2O
HCl气体
胶头滴管
H2O2
稀H2SO4
浓H2SO4
石灰水
A、A B、B C、C D、D13. 将等质量、等溶质质量分数的氢氧化钠溶液与稀硫酸充分混合,所得溶液与下列哪种物质不反应( )A、Fe B、CuSO4 C、HCl D、SO214. 向氢氧化钠溶液中不断滴入盐酸(每点反应都很充分),得到如图的曲线,下列有关判断不正确的是( )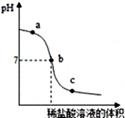 A、a点时溶液中有氢氧化钠和氯化钠 B、a点时的溶液能使紫色石蕊试液变红 C、b点时,HCl与NaOH恰好完全反应 D、b点到c点时,溶液中氯化钠的量不再增加15. 鉴别下列各组物质,所用试剂正确的是( )
A、a点时溶液中有氢氧化钠和氯化钠 B、a点时的溶液能使紫色石蕊试液变红 C、b点时,HCl与NaOH恰好完全反应 D、b点到c点时,溶液中氯化钠的量不再增加15. 鉴别下列各组物质,所用试剂正确的是( )待鉴别的物质
鉴别试剂
A
稀盐酸和稀硫酸
硝酸银溶液
B
氢氧化钡固体和氯化钡固体
水
C
氧气、二氧化碳气体
澄清的石灰水
D
氢氧化钠溶液和碳酸钠溶液
酚酞试液
A、A B、B C、C D、D二、填空题(本题共8小题,每空2分,共36分)
-
16. 在反应A+B═C+D中,5gA和10gB恰好完全反应,生成8gC;若2.5gA和足量的B反应,可生成D的质量是。17. 按下列要求,从①烧碱 ②盐酸 ③熟石灰 ④稀硫酸 ,中选出选出适当的物质,填在 相应的横线上(填标号):(1)、能降低土壤酸性和用于配制农药波尔多液的是;(2)、既有强烈的腐蚀性和易溶于水的性质,又可作某些气体干燥剂的物质是 。18. 酸碱反应与人们的日常生活和生产有密切的关系。(1)、由于人的胃里有胃酸,但胃液分泌过多会引起胃病,服用含有氢氧化铝的药物可缓解病痛。其治疗的化学原理为(用化学方程式表示)。(2)、做馒头发酵面团时,会产生乳酸等有机酸,蒸馒头前需加入适量的纯碱或小苏打等碱性物质,它们相互作用产生了(填化学式)气体,使蒸出的馒头疏松多孔。19. 铁是人类广泛使用的一种金属,与我们生活息息相关。(1)、日常生活中所用的铁制品一般都是铁的合金,生铁即是常用的一种铁合金,因此生铁属于 (填“纯净物”或“混合物”)。(2)、生活中我们常用铁锅炒菜,主要是利用了铁良好的性。20. 浓硫酸具有脱水性,能把小木棍、蔗糖等中的氢元素和氧元素“脱出”结合生成水。(1)、用小木棍蘸取浓硫酸少许,一段时间后,小木棍上出现的实验现象是。(2)、在蔗糖(C12H22O11)分子中,如果蔗糖完全脱水,则生成C和H2O的质量比是。21. 在化学反应中,反应物分子间相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起化学反应。下图表示HI分子之间的几种碰撞示意图,有些HI分子碰撞后,会发生化学反应产生H2和I2 , 有些碰撞不会发生反应。
 (1)、A,B,C三图中表示HI分子碰撞后发生了化学反应的是图;(2)、上述发生的反应属于化学基本反应类型中的反应;(3)、若要得到1个H2分子,至少需要个HI分子碰撞。22. 已知奥运五环中A、B、C、D、E为稀硫酸、氢氧化钠溶液,二氧化碳、氧化铁、水中的一种,且相连环内的两种物质能发生化学反应,E是常见的溶剂。请回答:
(1)、A,B,C三图中表示HI分子碰撞后发生了化学反应的是图;(2)、上述发生的反应属于化学基本反应类型中的反应;(3)、若要得到1个H2分子,至少需要个HI分子碰撞。22. 已知奥运五环中A、B、C、D、E为稀硫酸、氢氧化钠溶液,二氧化碳、氧化铁、水中的一种,且相连环内的两种物质能发生化学反应,E是常见的溶剂。请回答: (1)、B物质是。(2)、A与B的反应的实验现象是。(3)、写出B与C反应的化学方程式。23. 已知A、B、C、D、E、F为常见物质,其中A、B含有相同的元素,B、E为氧化物,C、D、F都为单质。它们相互转化的关系如图所示(图中反应条件去)。
(1)、B物质是。(2)、A与B的反应的实验现象是。(3)、写出B与C反应的化学方程式。23. 已知A、B、C、D、E、F为常见物质,其中A、B含有相同的元素,B、E为氧化物,C、D、F都为单质。它们相互转化的关系如图所示(图中反应条件去)。
(已知氢气与氧化铜在高温的条件下,会发生反应,生成金属铜单质和水)
(1)、X在反应①中起作用。(2)、写出有关物质的化学式:A ;C
三、实验探究题(本题共3小题,每空3分,共39分)
-
24. 为了探究化学反应前后物质的总质量是否发生改变,甲同学和乙同学分别设计了下面两个实验,请根据图示回答问题:
 (1)、甲同学设计的实验如图 A 所示,反应前,托盘天平的指针指向刻度盘的中间;两种物质反应后,托盘天平的指针会发生偏转吗?并说明理由。。(2)、两位同学通过交流反思得到启示:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在装置中进行。(3)、从微观角度分析,在化学反应前后一定不变的是(选填序号)。
(1)、甲同学设计的实验如图 A 所示,反应前,托盘天平的指针指向刻度盘的中间;两种物质反应后,托盘天平的指针会发生偏转吗?并说明理由。。(2)、两位同学通过交流反思得到启示:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在装置中进行。(3)、从微观角度分析,在化学反应前后一定不变的是(选填序号)。①原子种类 ②分子种类 ③原子数目
④分子质量 ⑤分子数目 ⑥原子质量
25. 实验室制氧气的两种方法如下:方法一:分解双氧水 方法二:2KMnO4
 K2MnO4+MnO2+O2↑(1)、写出方法一的化学反应方程式:。(2)、下图是实验室用于制取、干燥和收集气体的装置图。仪器a的名称是。组装一套实验室制取并收集较纯净的氧气的装置应选择下列中的(填序号)。现用方法一制取一瓶干燥的氧气,请按气体流向,用导管的编号将装置连接好。
K2MnO4+MnO2+O2↑(1)、写出方法一的化学反应方程式:。(2)、下图是实验室用于制取、干燥和收集气体的装置图。仪器a的名称是。组装一套实验室制取并收集较纯净的氧气的装置应选择下列中的(填序号)。现用方法一制取一瓶干燥的氧气,请按气体流向,用导管的编号将装置连接好。 26. 某兴趣小组在整理实验室时发现一瓶敞口放置的氢氧化钠固体,于是他们对这瓶氢氧化钠固体的成分展开探究.
26. 某兴趣小组在整理实验室时发现一瓶敞口放置的氢氧化钠固体,于是他们对这瓶氢氧化钠固体的成分展开探究.【提出问题】这瓶氢氧化钠固体是否变质?
【猜想假设】猜想一:没有变质,全部是NaOH;
猜想二:完全变质,全部是Na2CO3;
猜想三:。
【实验探究】为了探究固体成分,他们分别进行了如下实验:
⑴甲同学取少量固体于试管中,加水后有放热现象,说明这瓶固体中含有。
⑵写出氢氧化钠变质的化学方程式。
⑶为了进一步确定这瓶固体的成分,丙同学设计了如下方案,请你完成下列实验报告:
实验步骤
可能观察到的现象
结论
Ⅰ、取样于试管中,加水溶解,滴入过量的① (填化学式)溶液
产生白色沉淀
含有②
Ⅱ、反应后过滤,取上层清液,滴入酚酞溶液
无色酚酞溶液变红
③猜想正确
四、解答题(本题共6小题,第27、28、29、30、32小题各6分,第31小题8分,第33小题12分,共50分)
-
27. 山梨酸钾(化学式为C5H7COOK)是国际粮农组织和卫生组织推荐的高效安全的防腐保鲜剂,在我市海产品深加工过程中广泛使用。(1)、该物质是由 种元素组成,相对分子质量是。(2)、该物质中碳、氢元素的原子个数比是。28. 小强在厨房里发现一瓶没有标签的无色液体。(1)、他闻了闻,初步判断为白醋,小强是利用白醋的(填“物理”或“化学”)性质作出的判断。(2)、他另取少量此液体滴入石蕊试液,溶液变为色,要使其变为蓝色,可向其中加入 (填编号)
a、食盐 b、熟石灰 c、白酒 d、水
29. 实验室用分解双氧水的方法来制取氧气。现需氧气9.6克,则需过氧化氢的质量多少?30. 现有10克铁和铜的混合物,将它放入一定量的10%的稀硫酸中恰好完全反应,产生0.2克氢气,求:(铜与酸不反应)(1)、混合金属中铜的质量分数;(2)、参加反应的稀硫酸的质量。31. 向盛有26.4g硫酸钠和碳酸钠混合物的烧杯中加入218g稀硫酸,恰好完全反应,固体全部消失,烧杯内物质总质量变为240g,请计算:(1)、该反应生成二氧化碳的质量为g;(2)、原混合物中碳酸钠的质量.(3)、反应后所得溶液中溶质的质量分数.32. 某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16克放入烧杯,把80克稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,也不与稀盐酸反应).请计算:序号
第一次
第二次
第三次
第四次
加入稀盐酸的质量/克
20
20
20
20
剩余固体的质量/克
11
6
2.8
n
(1)、如表中n的数值为 。(2)、样品中碳酸钙的质量分数为 。(3)、小明同学计算所用盐酸的溶质质量分数,计算过程如下:解:设盐酸的溶质质量分数为x
CaCO3+
2HCl=CaCl2+H2O+CO2↑
100
73
13.2g
80x
100:73=13.2:80x
x=12%
小明的计算过程中存在明显错误,请你通过列式计算进行纠正?
33. 向含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为10%NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,据图回答: (1)、写出PM段发生的化学方程式。(2)、P点溶液中的溶质是。(3)、原混合物中CuCl2的质量是。(4)、试通过计算确定m1的值是。(5)、M点溶液的溶质质量分数是多少?(结果保留0.1%)
(1)、写出PM段发生的化学方程式。(2)、P点溶液中的溶质是。(3)、原混合物中CuCl2的质量是。(4)、试通过计算确定m1的值是。(5)、M点溶液的溶质质量分数是多少?(结果保留0.1%)