人教版化学高二选修4第三章第一节弱电解质的电离同步练习
试卷更新日期:2015-12-31 类型:同步测试
一、选择题
-
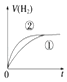
1. 相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )A、
 B、
B、 C、
C、 D、
D、 2. 下列说法正确的是( )A、电解质溶液的浓度越大,其导电性能一定越强 B、强酸和强碱一定是强电解质,不论其水溶液浓度大小,都能完全电离 C、强极性共价化合物不一定都是强电解质 D、多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强3. 0.1mol•L﹣1氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
2. 下列说法正确的是( )A、电解质溶液的浓度越大,其导电性能一定越强 B、强酸和强碱一定是强电解质,不论其水溶液浓度大小,都能完全电离 C、强极性共价化合物不一定都是强电解质 D、多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强3. 0.1mol•L﹣1氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )①电离程度增大 ②c(NH3•H2O)增大 ③NH4+数目增多
④c(OH﹣)增大 ⑤导电性增强 ⑥ 增大.
A、①②③ B、①③⑤ C、①③⑥ D、②④⑥4. 已知:HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是( )A、对比等浓度的两种酸的pH B、对比等浓度的两种酸,与相同大小镁条反应的初始速率 C、对比等浓度、等体积的两种酸,与等量NaOH溶液反应后放出的热量 D、对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积5. 在0.1mol•L﹣1CH3COOH溶液中存在如下电离平衡:CH3COOH⇌CH3COO﹣+H+ , 对于该平衡,下列叙述不正确的是( )A、加水稀释,电离平衡正向移动,溶液中n(H+)减小 B、加热,电离平衡正向移动,溶液中c(CH3COO﹣)增大 C、通入少量HCl气体,电离平衡逆向移动,溶液中c(H+)增大 D、加入少量CH3COONa固体,电离平衡逆向移动,溶液中c(H+)减小6. 下列说法正确的是( )A、强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 B、因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积、等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比中和盐酸消耗的NaOH的量少 C、足量Zn分别与等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不同 D、在物质的量浓度相同的磷酸钠溶液和磷酸溶液中PO43-的物质的量浓度相同7. 可以证明乙酸是弱酸的事实是( )A、乙酸和水能任意比例混溶 B、1mol•L﹣1的醋酸水溶液能使紫色石蕊试液变红色 C、醋酸能与碳酸钠溶液反应生成CO2气体 D、醋酸溶液中存在醋酸分子8.已知:(1)Al(OH)3的电离方程式为:AlO2﹣+H++H2O
 Al(OH)3=Al3++3OH﹣(2)无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl﹣(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb
Al(OH)3=Al3++3OH﹣(2)无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl﹣(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb则下列关于Al(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是( )
A、均为强电解质 B、均为弱电解质 C、均为离子化合物 D、均为共价化合物9. 下列电离方程式书写正确的是( )A、H2S⇌2H++S2﹣ B、Al(OH)3═Al3++3OH﹣ C、NH3•H2O⇌NH4++OH﹣ D、NaHCO3═Na++H++CO32﹣10. 下列电离方程式正确的是( )A、NaHCO3(溶液):NaHCO3=Na++H++CO32﹣ B、NaHSO4(熔融):NaHSO4=Na++H++SO42﹣ C、(NH4)2SO4(溶液):(NH4)2SO4=(NH4)2++SO42﹣ D、NH3•H2O(溶液):NH3•H2O⇌NH4++OH﹣11. 下列电离方程式中正确的是( )A、HF溶于少量水中:HF+H2O⇌F﹣+H3O+ B、H2S溶于水:H2S⇌2H++S2﹣ C、Na2HPO4溶于水:Na2HPO4═2Na++H++PO43﹣ D、NaHSO4熔融:NaHSO4═Na++H++SO42﹣12. 下列说法正确的是( )A、HClO和NaClO都是弱电解质 B、胶体能产生丁达尔效应,而溶液不能 C、1mol H2SO4与1mol Ba(OH)2反应放出的热量叫做中和热 D、HCl和NaCl溶于水破坏的化学键完全相同13. 下列事实能说明某物质是强电解质的是( )A、该物质在水中的溶解度大 B、该物质的水溶液导电能力强 C、该物质的水溶液中不存在溶质分子 D、该物质的水溶液中存在除水外的电离平衡14. 下列说法中正确的是( )A、氯化钠水溶液在电流的作用下电离出Na+和Cl﹣ B、硫酸钡难溶于水,但硫酸钡属于强电解质 C、二氧化碳溶于水能部分电离,所以二氧化碳属于弱电解质 D、硫酸钠在水中的电离方程式可表示为Na2SO4═2Na++S6++4O2﹣15. 下列有关电解质的说法错误的是( )A、强电解质溶液的导电性不一定强于弱电解质溶液的导电性 B、电解质溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数 C、易溶物是强电解质,难溶物一定是弱电解质 D、硫酸钡在水里的溶解度很小,但溶于水的硫酸钡全部电离,所以硫酸钡是强电解质16. 下列说法正确的一组是:①不溶于水的盐都是弱电解质;②可溶于水的盐一定都是强电解质;③0.5mol/L一元酸溶液H+浓度一定为0.5mol/L;④强酸溶液中的H+浓度一定大于弱酸溶液中的H+浓度;⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子;⑥熔融的电解质都能导电( )A、①③⑤⑥ B、②④⑤⑥ C、只有⑤ D、只有⑥17. 可以证明次氯酸是弱酸的事实是( )A、可与碱反应 B、有漂白性 C、见光能分解 D、次氯酸钙溶液可与碳酸反应生成次氯酸18. 下列事实能说明碳酸的酸性比乙酸弱的是( )A、乙酸能发生酯化反应,而碳酸不能 B、碳酸和乙酸都能与碱反应 C、乙酸易挥发,而碳酸不稳定易分解 D、乙酸和Na2CO3反应可放出CO219. 对常温下 c(H+)=0.001 mol•L﹣1的CH3COOH溶液,下列叙述不正确的是( )A、c(H+)=c(CH3COO﹣)+c(OH﹣) B、加入少量CH3COONa固体后,c(CH3COO﹣)增大 C、与等体积c(OH﹣)=0.001 mol•L﹣1的NaOH溶液混合后所得溶液显碱性 D、与等体积c(OH﹣)=0.001 mol•L﹣1的NaOH溶液混合后所得溶液显酸性20. 室温下向10mL c(H+)=0.001 mol•L﹣1的醋酸溶液中加水稀释后,下对说法正确的是( )A、溶液中导电粒子的数目减少 B、醋酸的电离程度增大,c(H+)亦增大 C、溶液中 不变 D、再加入c(OH﹣)=0.001 mol•L﹣1的NaOH溶液,混合液的pH=7二、非选择题
-
21. 在氢氟酸溶液中,存在下列电离平衡:HF⇌H++F﹣ ,(1)、加入NaOH固体后,电离平衡向(填“正”或“逆”)反应方向移动,c(H+)(填“增大”,“减小”或“不变”).
(2)、加入NaF固体后,电离平衡向(填“正”或“逆”)反应方向移动,c(H+)(填“增大”,“减小”或“不变”).
(3)、加水稀释,电离平衡向(填“正”或“逆”)反应方向移动,c(H+)(填“增大”,“减小”或“不变”).
22.一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
 (1)、冰醋酸在O点时是否导电(填是或否),理由是 .(2)、H+的物质的量最大的是(填“a”、“b”或“c”).(3)、若使c点溶液中的c(CH3COO﹣)增大,可以采取下列措施中的( )A、加热 B、加很稀的NaOH溶液 C、加NaOH固体 D、加水 E、加固体CH3COONa F、加入锌粒.23. 已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:(1)、该溶液中c(H+)= .(2)、HA的电离平衡常数K=;(3)、升高温度时,K(填“增大”,“减小”或“不变”).24. 在稀氨水中存在下述电离平衡NH3+H2O⇌NH3•H2O⇌NH4++OH﹣ , 分别加入少量下列物质,溶液中c(OH﹣)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?
(1)、冰醋酸在O点时是否导电(填是或否),理由是 .(2)、H+的物质的量最大的是(填“a”、“b”或“c”).(3)、若使c点溶液中的c(CH3COO﹣)增大,可以采取下列措施中的( )A、加热 B、加很稀的NaOH溶液 C、加NaOH固体 D、加水 E、加固体CH3COONa F、加入锌粒.23. 已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:(1)、该溶液中c(H+)= .(2)、HA的电离平衡常数K=;(3)、升高温度时,K(填“增大”,“减小”或“不变”).24. 在稀氨水中存在下述电离平衡NH3+H2O⇌NH3•H2O⇌NH4++OH﹣ , 分别加入少量下列物质,溶液中c(OH﹣)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?加入的物质
少量(NH4)2SO4固体
少量HNO3溶液
少量KOH溶液
c(OH﹣)的变化
①
②
③
平衡移动方向
④
⑤
⑥
25. 有浓度为0.1mol•L﹣1的盐酸、硫酸、醋酸三种溶液,试回答:(1)、三种溶液中c(H+) 依次为a mol•L﹣1 , b mol•L﹣1 , c mol•L﹣1 , 其大小顺序为 .(2)、等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n 1mol,n2 mol,n3 mol,它们的大小关系为
(3)、中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为(4)、与锌反应时产生氢(气)的速率分别为v1、v2、v3 , 其大小关系为 .