人教版化学高二选修3第一章第二节原子结构与元素的性质同步练习
试卷更新日期:2015-12-30 类型:同步测试
一、选择题
-
1. 下列四种元素中,其单质氧化性最强的是( )A、原子含有未成对电子最多的第二周期元素 B、位于周期表中第三周期ⅢA族的元素 C、原子最外电子层排布为2s22p4的元素 D、原子最外电子层排布为3s23p3的元素2.
下面是元素周期表的一部分(表中数字和X代表原子序数),其中X为35的是( )
 A、A B、B C、C D、D3. 下列说法中正确的是( )A、主族元素的价电子全排布在最外层的ns或np轨道上 B、过渡元素的原子,价电子排布全部为(n-1)d1~10ns2 C、d轨道不可以参与化学键的形成 D、所有元素的共同特点是原子的价电子都排布在最外电子层上4. 具有下列电子层结构的原子,其对应的元素一定属于同一周期的是( )A、两种元素原子的电子层上全部都是s电子 B、3p能级上只有1个空轨道的原子和3p能级上只有1个未成对电子的原子 C、最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 D、原子核外的M层上的s、p能级上都填满了电子而d轨道未排电子的两种原子5. 第七周期为不完全周期,若将来发现的元素把这一周期全部排满,则下列有关第七周期元素的推论可能错误的是( )A、第七周期排满时有32种元素,全部是放射性元素 B、第七周期排满时最后一种元素的单质常温常压下是气体 C、第七周期ⅦA族元素的原子序数为117,是一种金属元素 D、第七周期ⅢA族元素的氢氧化物与Al(OH)3具有相似的化学性质6. 甲、乙两元素原子的L层电子数都是其他层电子总数的2倍。下列推论正确的是( )A、甲与乙处于同一周期 B、甲与乙处于同一主族 C、甲与乙都位于元素周期表的p区 D、甲与乙的原子序数之和为偶数7. 肯定属于同族元素且性质相似的是( )A、原子电子排布式:A为1s22s2 , B为1s2 B、结构示意图:A为
A、A B、B C、C D、D3. 下列说法中正确的是( )A、主族元素的价电子全排布在最外层的ns或np轨道上 B、过渡元素的原子,价电子排布全部为(n-1)d1~10ns2 C、d轨道不可以参与化学键的形成 D、所有元素的共同特点是原子的价电子都排布在最外电子层上4. 具有下列电子层结构的原子,其对应的元素一定属于同一周期的是( )A、两种元素原子的电子层上全部都是s电子 B、3p能级上只有1个空轨道的原子和3p能级上只有1个未成对电子的原子 C、最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 D、原子核外的M层上的s、p能级上都填满了电子而d轨道未排电子的两种原子5. 第七周期为不完全周期,若将来发现的元素把这一周期全部排满,则下列有关第七周期元素的推论可能错误的是( )A、第七周期排满时有32种元素,全部是放射性元素 B、第七周期排满时最后一种元素的单质常温常压下是气体 C、第七周期ⅦA族元素的原子序数为117,是一种金属元素 D、第七周期ⅢA族元素的氢氧化物与Al(OH)3具有相似的化学性质6. 甲、乙两元素原子的L层电子数都是其他层电子总数的2倍。下列推论正确的是( )A、甲与乙处于同一周期 B、甲与乙处于同一主族 C、甲与乙都位于元素周期表的p区 D、甲与乙的原子序数之和为偶数7. 肯定属于同族元素且性质相似的是( )A、原子电子排布式:A为1s22s2 , B为1s2 B、结构示意图:A为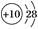 ,B为
,B为  C、A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D、A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
8. 下列关于粒子半径的说法中,正确的是( )A、电子层数少的元素,其原子半径一定小于电子层数多的元素的原子半径 B、核外电子层结构相同的单核粒子的半径相同 C、质子数相同的不同单核粒子,电子数越多半径越大 D、原子序数越大,原子半径越大9. 下列有关电离能的说法中,正确的是( )A、第一电离能越大的原子失电子的能力越强 B、第一电离能是元素的原子失去核外第一个电子需要的能量 C、同一周期中,主族元素原子第一电离能从左到右越来越大 D、可通过一种元素各级电离能的数值,判断元素可能的化合价10. X和Y是原子序数大于4的短周期元素,Xm+和Yn-两种离子的核外电子排布相同,下列说法中,正确的是( )A、X的原子半径比Y小 B、X和Y的核电荷数之差为m-n C、电负性:X>Y D、第一电离能:X<Y11. 下列有关电负性的说法中,不正确的是( )A、元素的电负性越大,原子在化合物中吸引电子的能力越强 B、主族元素的电负性越大,元素原子的第一电离能一定越大 C、在元素周期表中,元素电负性从左到右呈现递增的趋势 D、形成化合物时,电负性越小的元素越容易显示正价12. 下列说法正确的是( )A、SiH4比CH4稳定 B、O2-半径比F-的小 C、Na和Cs属于第ⅠA族元素,Cs失电子能力比Na强 D、P和As属于第ⅤA族元素,H3PO4的酸性比H3AsO4的弱13. 下列各组中的X和Y两种原子,在周期表中一定位于同一族的是( )A、X原子和Y原子最外层都只有一个电子 B、X原子的电子排布式为1s2 , Y原子的电子排布式为1s22s2 C、X原子的2p能级上有三个电子,Y原子的3p能级上有三个电子 D、X原子核外M层上仅有两个电子,Y原子核外N层上也仅有两个电子14. 短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子的最外层电子数的3倍。下列说法正确的是( )A、X的氢化物溶于水显酸性 B、Y原子的电子排布式为1s22s22p63s2 C、Z元素在周期表中的位置为第三周期第Ⅵ族 D、X和Z的最高价氧化物对应水化物都是弱酸15. 根据表中信息,下列叙述正确的是( )
C、A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D、A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
8. 下列关于粒子半径的说法中,正确的是( )A、电子层数少的元素,其原子半径一定小于电子层数多的元素的原子半径 B、核外电子层结构相同的单核粒子的半径相同 C、质子数相同的不同单核粒子,电子数越多半径越大 D、原子序数越大,原子半径越大9. 下列有关电离能的说法中,正确的是( )A、第一电离能越大的原子失电子的能力越强 B、第一电离能是元素的原子失去核外第一个电子需要的能量 C、同一周期中,主族元素原子第一电离能从左到右越来越大 D、可通过一种元素各级电离能的数值,判断元素可能的化合价10. X和Y是原子序数大于4的短周期元素,Xm+和Yn-两种离子的核外电子排布相同,下列说法中,正确的是( )A、X的原子半径比Y小 B、X和Y的核电荷数之差为m-n C、电负性:X>Y D、第一电离能:X<Y11. 下列有关电负性的说法中,不正确的是( )A、元素的电负性越大,原子在化合物中吸引电子的能力越强 B、主族元素的电负性越大,元素原子的第一电离能一定越大 C、在元素周期表中,元素电负性从左到右呈现递增的趋势 D、形成化合物时,电负性越小的元素越容易显示正价12. 下列说法正确的是( )A、SiH4比CH4稳定 B、O2-半径比F-的小 C、Na和Cs属于第ⅠA族元素,Cs失电子能力比Na强 D、P和As属于第ⅤA族元素,H3PO4的酸性比H3AsO4的弱13. 下列各组中的X和Y两种原子,在周期表中一定位于同一族的是( )A、X原子和Y原子最外层都只有一个电子 B、X原子的电子排布式为1s2 , Y原子的电子排布式为1s22s2 C、X原子的2p能级上有三个电子,Y原子的3p能级上有三个电子 D、X原子核外M层上仅有两个电子,Y原子核外N层上也仅有两个电子14. 短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子的最外层电子数的3倍。下列说法正确的是( )A、X的氢化物溶于水显酸性 B、Y原子的电子排布式为1s22s22p63s2 C、Z元素在周期表中的位置为第三周期第Ⅵ族 D、X和Z的最高价氧化物对应水化物都是弱酸15. 根据表中信息,下列叙述正确的是( )短周期元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.089
0.104
0.066
主要化合价
+2
+3
+2
+6,-2
-2
A、氢化物的热稳定性:H2T<H2R B、单质与稀盐酸反应的速率:L<Q C、离子半径:R2-<L2+ D、M与T形成的化合物既能与强酸反应,又能与强碱反应16. 对Na、Mg、Al的有关性质的叙述不正确的是( )A、第一电离能:Na<Mg<Al B、电负性:Na<Mg<Al C、还原性:Na>Mg>Al D、碱性:NaOH>Mg(OH)2>Al(OH)317. 下列关于元素第一电离能的说法不正确的是( )A、钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 B、因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 C、最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 D、对于同一元素而言,原子的逐级电离能越来越大18. 下列四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4 ②1s22s22p63s23p3
③1s22s22p3④1s22s22p5
则下列有关的比较中正确的是( )
A、第一电离能:④>③>②>① B、原子半径:④>③>②>① C、电负性:④>③>②>① D、最高正化合价:④>③=②>①19. A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:①原子半径A<B,②离子半径A>B,③原子序数A>B,④原子最外层电子数A<B,⑤A的正价与B的负价绝对值一定相等,⑥A的电负性小于B的电负性,⑦A的第一电离能大于B的第一电离能。其中正确的是( )A、①②⑦ B、③④⑥ C、③⑤ D、③④⑤⑥⑦20. 下表中是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )元素
A
B
C
D
E
最低化合价
-4
-2
-1
-2
-1
电负性
2.5
2.5
3.0
3.5
4.0
A、C D E的氢化物的稳定性:C>D>E B、元素A的原子最外层轨道中无自旋状态相同的电子 C、元素B C之间不可能形成化合物 D、与元素B同周期且第一电离能最小的元素的单质能与H2O发生置换反应二、非选择题
-
21.
下表为元素周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
① 表中属于d区的元素是(填编号)。
②表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为。
③某元素的特征电子排布式为nsnnpn+1 , 该元素原子的最外层电子的孤电子对数为。
④某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:。
22. W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。①W位于元素周期表第周期第族。W的气态氢化物的稳定性比H2O(g)(填“强”或“弱”)。
②Y的基态原子核外电子排布式为 , Y的第一电离能比X的(填“大”或“小”)。
③Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方式是。
23. 假定元素周期表是有限的,根据已知的元素周期表的某些事实和理论可归纳出一些假说。①已知元素周期表中的各周期可排元素种类如下:
周期
1
2
3
4
5
6
7
元素种类
2
8
8
18
18
32
32
人们预测元素周期表第八周期将来也会排满,那么该周期排满后的元素种数是。
A.18 B.32
C.50 D.无法判断
②根据每个周期最后一种金属元素出现的族序数,预测周期表中原子序数最大的金属元素将在周期族(注:把0族看做ⅧA族)。周期表中元素在填满周期后将结束。
③根据周期表中每个周期非金属元素的种数(把稀有气体元素看做非金属元素),预测周期表中应该有种非金属元素,还有种未发现。未发现的非金属元素处于周期族。
24. X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:元素
相关信息
X
X的基态原子L层电子数是K层电子数的2倍
Y
价电子排布式为:nsnnpn+2
Z
Z存在质量数为23,中子数为12的核素
W
W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色
(1)、W位于元素周期表第周期第族,其基态原子最外层有个电子。(2)、X的电负性比Y的(填“大”或“小”);X和Y的气态氢化物中,较稳定的是(写化学式)。(3)、写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目:。25.下表列出了前20号元素中某些元素性质的一些数据:

试回答下列问题:
(1)、以上10种元素中,第一电离能最小的是(填编号)。(2)、上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8e-稳定结构的物质可能是(写分子式)。元素⑨和⑩形成的化合物的化学式为;元素①的原子价电子排布式是。(3)、①、⑥、⑦、⑩四种元素的气态氢化物的稳定性,由强到弱的顺序是(填化学式)。(4)、③和⑨两元素比较,非金属性较弱的是(填名称),可以验证你的结论的是下列中的(填序号)。A.气态氢化物的挥发性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表③和⑨两元素)
F.两单质在自然界中的存在形式