上海市2019年中考化学试卷
试卷更新日期:2019-08-08 类型:中考真卷
一、单选题
-
1. 属于稀有气体的是()A、氮气 B、氦气 C、氢气 D、氧气2. 能使紫色石蕊试液变蓝的是()A、水 B、石灰水 C、稀硫酸 D、稀盐酸3. 灼烧氯化钠,火焰呈()A、黄色 B、红色 C、绿色 D、紫鱼4. 能提供氮元素的化肥是()A、KCl B、K2CO3 C、NH4Cl D、Ca(H2PO4)25. Fe2O3中Fe的化合价是()A、-3 B、-2 C、+2 D、+36. 放入一定量水中,充分搅拌后形成乳浊液的是()A、蔗糖 B、麻油 C、食盐 D、白醋7. 图示实验操作规范的是()A、
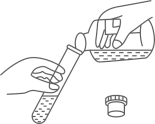 取用液体
B、
取用液体
B、 滴加液体
C、
滴加液体
C、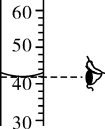 量筒读数
D、
量筒读数
D、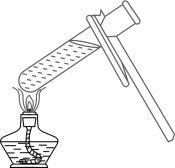 加热液体
8. 净水过程中可加入的吸附剂是()A、活性炭 B、生石灰 C、熟石灰 D、烧碱9. 在氧气中燃烧,产生明亮蓝紫色火焰的是()A、硫 B、红磷 C、铁丝 D、氢气10. 瓶中CO气体分子的微观示意图为(●表示C原子,“
加热液体
8. 净水过程中可加入的吸附剂是()A、活性炭 B、生石灰 C、熟石灰 D、烧碱9. 在氧气中燃烧,产生明亮蓝紫色火焰的是()A、硫 B、红磷 C、铁丝 D、氢气10. 瓶中CO气体分子的微观示意图为(●表示C原子,“ ”表示O原子)() A、
”表示O原子)() A、 B、
B、 C、
C、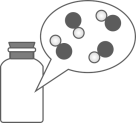 D、
D、 11. 有关CuSO4说法正确的是()A、俗称胆矾 B、可检验水的存在 C、摩尔质量为160 D、不含原子团12. 一定条件下,能与二氧化碳反应的是()A、木炭 B、一氧化碳 C、氧化铜 D、氧气13. 能鉴别氢氧化钠溶液和碳酸钠溶液的是()A、酚酞试液 B、盐酸 C、氢氧化钾溶液 D、碳酸钾溶液14. 实验室制氧气的化学方程式书写正确的是()A、KClO3 KCl+O2↑ B、2KClO3=2KCl+3O2↑ C、2H2O2 2H2O+O2↑ D、H2O2 2H2↑+O2↑15. 能使气体物质溶解度增大的操作是()A、增加溶剂 B、振荡溶液 C、增大压强 D、升高温度16. 燃烧前常将汽油(含C8H18等)喷成雾状,可以()A、减少O2消耗量 B、增大汽油与空气的接触面 C、减少CO2生成量 D、使C8H18等分子变得更小17. 只含一种分子的物质一定是()A、单质 B、化合物 C、纯净物 D、混合物18. 25℃时,pH=1的盐酸与pH=13的氢氧化钠溶液混合,立即测定混合液的温度T,然后测定混合液的pH(25℃时)。有关判断合理的是()A、T=25℃ pH=7 B、T=25℃ 1≤pH≤13 C、T>25℃ pH=14 D、T>25℃ 1<pH<1319. 含氧元素质量相同的SO2和SO3 , 具有相同的()A、硫元素质量 B、质量 C、氧原子个数 D、分子个数20. 一定量甲烷(CH4)在氧气中不完全燃烧,生成一氧化碳、二氧化碳和水的物质的量之比可能为()A、1:1:2 B、2:1:4 C、2:3:6 D、3:1:8
11. 有关CuSO4说法正确的是()A、俗称胆矾 B、可检验水的存在 C、摩尔质量为160 D、不含原子团12. 一定条件下,能与二氧化碳反应的是()A、木炭 B、一氧化碳 C、氧化铜 D、氧气13. 能鉴别氢氧化钠溶液和碳酸钠溶液的是()A、酚酞试液 B、盐酸 C、氢氧化钾溶液 D、碳酸钾溶液14. 实验室制氧气的化学方程式书写正确的是()A、KClO3 KCl+O2↑ B、2KClO3=2KCl+3O2↑ C、2H2O2 2H2O+O2↑ D、H2O2 2H2↑+O2↑15. 能使气体物质溶解度增大的操作是()A、增加溶剂 B、振荡溶液 C、增大压强 D、升高温度16. 燃烧前常将汽油(含C8H18等)喷成雾状,可以()A、减少O2消耗量 B、增大汽油与空气的接触面 C、减少CO2生成量 D、使C8H18等分子变得更小17. 只含一种分子的物质一定是()A、单质 B、化合物 C、纯净物 D、混合物18. 25℃时,pH=1的盐酸与pH=13的氢氧化钠溶液混合,立即测定混合液的温度T,然后测定混合液的pH(25℃时)。有关判断合理的是()A、T=25℃ pH=7 B、T=25℃ 1≤pH≤13 C、T>25℃ pH=14 D、T>25℃ 1<pH<1319. 含氧元素质量相同的SO2和SO3 , 具有相同的()A、硫元素质量 B、质量 C、氧原子个数 D、分子个数20. 一定量甲烷(CH4)在氧气中不完全燃烧,生成一氧化碳、二氧化碳和水的物质的量之比可能为()A、1:1:2 B、2:1:4 C、2:3:6 D、3:1:8二、填空题
-
21. 新中国成立70年来,我国化学工业得到长足发展。
①积极开发燃料酒精等石油替代品。酒精(C2H6O)由种元素组成,属于(选填“有机物”或“无机物”)。酒精燃烧属于(选填“物理”或“化学”)变化。
②人造金刚石世界闻名。金刚石硬度大,可用于。金刚石、(填物质名称)和碳60互为同素异形体,其中碳元素以(选填“游离”或“化合”)态存在。
③光伏产品遍及全球。生产中涉及反应:SiO2+2C Si+2X↑。X的化学式是。1molSiO2中约含 个Si原子。
三、实验题
-
22. 实验室制备并收集二氧化碳。
①选用药品。按下表进行实验,取等质量的大理石加入足量酸中(杂质不与酸反应),产生二氧化碳体积随时间变化曲线如下图所示:
实验编号
药品
Ⅰ
块状大理石、10%H2SO4溶液
Ⅱ
块状大理石、7%HCl溶液
Ⅲ
大理石粉末、7%HCl溶液

图中丙对应实验(选填“I”“Ⅱ”或“Ⅲ”)。确定用乙对应的药品制备并收集二氧化碳,相应的化学方程式是;不用甲对应的药品,理由是。搭建装置。
②组装简易启普发生器,应选用(选填编号)。

③收集二氧化碳。用下图装置收集时,空气从(选填“x”或“y”)端排出。

④检验二氧化碳。写出检验时反应的化学方程式。
23. 研究物质的溶解对于生产、生活有着重要意义。①下表是硝酸钾的部分溶解度数据。
温度(℃)
20
40
60
80
溶解度(g/100g水)
31.6
63.9
110
169
由表中数据可知,硝酸钾的溶解度随温度升高而(选填“变大”或“变小”)。60℃时硝酸钾饱和溶液中,溶质与溶剂的质量比为 , 能将该饱和溶液转化为不饱和溶液的一种方法是。
②探究20℃时配制硝酸钾溶液过程中,溶质质量分数与加入水的质量关系。向硝酸钾中分批加水,充分搅拌,现象如下图所示:

坐标图中,符合实验结果的描点可能是(选填编号)。

③取等质量甲和乙两种物质(均不含结晶水)进行如下图所示实验,最终烧杯中析出固体的质量乙大于甲。

40℃时,甲的溶解度 (选填“大于”“等于”或“小于”)乙的溶解度根据本实验结果,能否判断40~80℃间甲、乙哪种物质的溶解度变化随温度影响更大 (选填“能”或“不能”)。
24. 某混合溶液含一定量的硝酸银、硝酸铜和硝酸钡,为逐一沉淀分离其中的金属元素,从稀盐酸、稀硫酸、氢氧化钠稀溶液、氯化钠溶液、硫酸钠溶液中选择试剂进行实验。①甲的实验如下表所示:
步骤
操作
现象与解释
Ⅰ
向混合溶液中加入过量稀盐酸,充分反应后过滤
得到白色沉淀,相应的化学方程式是
Ⅱ
向Ⅰ中滤液加入过量稀硫酸,充分反应后过滤
得到色沉淀
Ⅲ
向Ⅱ中滤液加入过量氢氧化钠稀溶液,充分反应后过滤
得到蓝色沉淀,该沉淀的化学式是
在Ⅱ中,需确认钡元素是否完全沉淀。甲在此环节的部分实验记录如下图所示:

请根据这部分记录,指出该环节中甲存在的具体问题并说明理由。
②乙仅调整了甲实验中所加试剂的顺序,既达到了实验目的,理论上又减少了氢氧化钠的消耗量。乙所加试剂依次为
③丙设计了一种新的方案,不仅达到了实验目的,而且理论上氢氧化钠的消耗量减到最少丙所加试剂依次为
四、简答题
-
25. 实验室以氧化铜、铁粉和稀硫酸为原料制备铜。
①方法一:氧化铜
 硫酸铜溶液
硫酸铜溶液  铜
铜I中反应的化学方程式是 ;Ⅱ中反应的基本类型是。该方法利用了铁的金属活动性比铜(选填“强”或“弱”)。
②方法二:用铁粉与稀硫酸制得氢气进行如图实验。

仪器a的名称是。通入氢气的导管末端应位于试管(选填“I”“Ⅱ”或“Ⅲ”)处。该制备铜的方法利用了氢气的性。0.1mol氧化铜与足量氢气反应,计算参加反应氢气的质量(根据化学方程式列式计算)
③通过比较,写出方法一和方法二各自的一条优点。
-