贵州省遵义市2019年中考化学试卷
试卷更新日期:2019-08-08 类型:中考真卷
一、单选题
-
1. 下列物质放入水中,能形成溶液的是()A、泥沙 B、食盐 C、植物油 D、粉笔灰2. 自来水生产的过程有以下步骤,发生化学变化的是()A、沉降 B、吸附 C、过滤 D、消毒3. 下列措施有利于节能减排、保护环境的是()A、研发可降解的塑料 B、加快化石燃料的开发和利用 C、焚烧秸秆给农田做肥料 D、工厂通过加高烟囱排放废气4. 实验室配制一定溶质质量分数的氢氧化钠溶液,下列操作正确的是()A、
 取用
B、
取用
B、 称取
C、
称取
C、 量取
D、
量取
D、 溶解
5. 下列有关安全常识的叙述,正确的是()A、冬天用炭火取暖时关闭门窗 B、进入面粉厂时可穿鞋底带铁钉的鞋子 C、从火灾现场逃生时用湿毛巾捂住口鼻 D、误食重金属盐中毒后,为减轻毒性应立即喝盐水6. 接近毒品就是走向死亡,摇头丸是一种新型毒品,吸食后对身体有严重的危害,其主要成分是MDMA(化学式为C11H15NO2),下列说法错误的是()A、MDMA由4种元素组成 B、一个MDMA分子中含有29个原子 C、MDMA的相对分子质量为193g D、MDMA中氢,氮元素的质量比为15:147. 大气中二氧化碳等气体含量升高,会导致温室效应,如图是将二氧化碳转化为化工原料乙烯(化学式为C2H4)的微观示意图,下列说法正确的是()
溶解
5. 下列有关安全常识的叙述,正确的是()A、冬天用炭火取暖时关闭门窗 B、进入面粉厂时可穿鞋底带铁钉的鞋子 C、从火灾现场逃生时用湿毛巾捂住口鼻 D、误食重金属盐中毒后,为减轻毒性应立即喝盐水6. 接近毒品就是走向死亡,摇头丸是一种新型毒品,吸食后对身体有严重的危害,其主要成分是MDMA(化学式为C11H15NO2),下列说法错误的是()A、MDMA由4种元素组成 B、一个MDMA分子中含有29个原子 C、MDMA的相对分子质量为193g D、MDMA中氢,氮元素的质量比为15:147. 大气中二氧化碳等气体含量升高,会导致温室效应,如图是将二氧化碳转化为化工原料乙烯(化学式为C2H4)的微观示意图,下列说法正确的是() A、分子是化学反应中的最小粒子 B、参加反应的H2和CO2的分子个数比为4:1 C、该反应不遵循质量守恒定律 D、该反应实现了无机物与有机物的转化8. 类推的思维方法在化学学习中应用广泛,下列类推正确的是()A、离子是带电荷的粒子,则带电荷的粒子是离子 B、原子核由质子和中子构成,则原子中都有质子和中子 C、碱溶液能使酚酞变红,则能使酚酞变红的溶液是碱溶液 D、铁在高温的空气中容易生锈,则隔绝氧气和水可以防止铁生锈9. 下列各组离子能够在指定溶液中大量共存的一组是()A、在氯化钠溶液中:Zn2+ , SO42﹣ B、在稀盐酸中:Ag+、NO3﹣ C、在硫酸钾溶液中:Ba2+、Cl﹣ D、在硝酸铵溶液中:K+、OH﹣10. 数形结合能对化学反应进行定量描述,下列图象能正确反映对应变化关系的是()A、
A、分子是化学反应中的最小粒子 B、参加反应的H2和CO2的分子个数比为4:1 C、该反应不遵循质量守恒定律 D、该反应实现了无机物与有机物的转化8. 类推的思维方法在化学学习中应用广泛,下列类推正确的是()A、离子是带电荷的粒子,则带电荷的粒子是离子 B、原子核由质子和中子构成,则原子中都有质子和中子 C、碱溶液能使酚酞变红,则能使酚酞变红的溶液是碱溶液 D、铁在高温的空气中容易生锈,则隔绝氧气和水可以防止铁生锈9. 下列各组离子能够在指定溶液中大量共存的一组是()A、在氯化钠溶液中:Zn2+ , SO42﹣ B、在稀盐酸中:Ag+、NO3﹣ C、在硫酸钾溶液中:Ba2+、Cl﹣ D、在硝酸铵溶液中:K+、OH﹣10. 数形结合能对化学反应进行定量描述,下列图象能正确反映对应变化关系的是()A、 一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉
B、
一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉
B、 等质量的碳酸钙与足量溶质质量分数相同的稀盐酸反应
C、
等质量的碳酸钙与足量溶质质量分数相同的稀盐酸反应
C、 等质量的铁粉和锌粉分别与足量溶质质量分数相同的稀硫酸反应
D、
等质量的铁粉和锌粉分别与足量溶质质量分数相同的稀硫酸反应
D、 高温条件下一氧化碳还原氧化铁
高温条件下一氧化碳还原氧化铁
二、填空题
-
11. 妈妈为小华准备了一份晚餐,有米饭、清蒸鱼、豆腐汤、青椒肉丝、凉拌黄瓜。(1)、上述食物中富含淀粉的是。(2)、烹调中使用了加铁酱油,酱油中加“铁”是为了防止缺铁引起的。(3)、餐桌上的餐具有竹筷,塑料水杯、不锈钢勺子,其中塑料属于(填“合成”或“无机非金属”)材料。(4)、食物中的淀粉在人体内转化为葡萄糖,葡萄糖发生缓慢氧化,提供能量,反应的化学方程式有:R+6O2 6CO2+6H2O,请判断R的化学式为。(5)、小华洗碗时发现铝盆失去了金属光泽,这是由于(用化学方程式表示)。
三、实验题
-
12. 科学家认为:“氢就将成为未来的主要能源”。2017年10月世界首列使用氢燃料电池的有轨电车在河北唐山投入商业运转,标志着我国氢能源的利用上了一个新台阶。(1)、氢燃料电池是将能转化为电能。(2)、氢气被称为“绿色能源”的主要原因是。(3)、如图是实验中的常用装置,请回答下列问题:
图一
 图二
图二 
图三

①写出仪器a的名称。
②实验室常用图一装置来制取氢气,反应的化学方程式为 , 该装置的优点是。
③若用稀盐酸制取氢气,会含有少量杂质,用图二装置可得到干燥、纯净的氢气,导管气流方向接接顺序正确的是(填字母)。
(4)、用上述干燥,纯净的氢气进行如图三所示的实验,测定混合固体中CuO的质量分数。已知:反应前A装置中CuO样品的质量为m1g,(样品中的其它物质不与H2反应),反应结束后装置B增重m2g,试用m1、m2表示样品中CuO的质量分数为。13. 某固体物质(不含结晶水)的溶解度曲线如图,M、N两点分别表示该物质在不同温度下的两种溶液,当条件改变时,溶液的状态在图中对应的点的位置可能随之变化,回答下列问题: (1)、M点表示该物质在与t2℃的(填“饱和”或”不饱和”)溶液。(2)、将M点所示的溶液变到N点所示的溶液,可以将M点的溶液降温至t1℃,过滤除去析出的晶体后,再将溶液升温至℃。(3)、t2℃时,若M点所示溶液的质量为70g,其中含溶质g.再将该溶液降温到t1℃,溶液的溶质质量分数变为(保留一位小数)。(4)、当恒温蒸发溶剂时,M、N两点的位置变化正确的是_____(填字母)A、M、N点均不动 B、M、N点均垂直上移 C、M点沿曲线下移;N点垂直上移 D、M点不动:N点垂直上移至曲线,不再变动14. “对比实验”是科学探究的重要方法,根据下列所示的实验示意图回答问题。
(1)、M点表示该物质在与t2℃的(填“饱和”或”不饱和”)溶液。(2)、将M点所示的溶液变到N点所示的溶液,可以将M点的溶液降温至t1℃,过滤除去析出的晶体后,再将溶液升温至℃。(3)、t2℃时,若M点所示溶液的质量为70g,其中含溶质g.再将该溶液降温到t1℃,溶液的溶质质量分数变为(保留一位小数)。(4)、当恒温蒸发溶剂时,M、N两点的位置变化正确的是_____(填字母)A、M、N点均不动 B、M、N点均垂直上移 C、M点沿曲线下移;N点垂直上移 D、M点不动:N点垂直上移至曲线,不再变动14. “对比实验”是科学探究的重要方法,根据下列所示的实验示意图回答问题。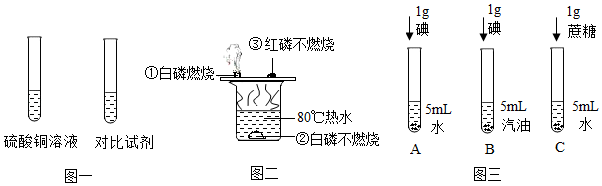 (1)、硫酸铜溶液呈蓝色,为探究哪种粒子使溶液显蓝色,可选择用作对比的试剂是溶液。(2)、如图二,现象①②说明物质燃烧需要与(填名称)接触,实验中发生了异常,白磷燃烧时有火星飞溅到红磷上,引起红磷燃烧,证明了燃烧的另一个条件是。(3)、①如图三,同学们做了试管A、B的对比实验,发现试管A中固体几乎不溶,试管B中固体全部溶解,该实验说明了影响物质溶解性的因素是。
(1)、硫酸铜溶液呈蓝色,为探究哪种粒子使溶液显蓝色,可选择用作对比的试剂是溶液。(2)、如图二,现象①②说明物质燃烧需要与(填名称)接触,实验中发生了异常,白磷燃烧时有火星飞溅到红磷上,引起红磷燃烧,证明了燃烧的另一个条件是。(3)、①如图三,同学们做了试管A、B的对比实验,发现试管A中固体几乎不溶,试管B中固体全部溶解,该实验说明了影响物质溶解性的因素是。②同学们又补充了试管C所示实验,他们想探究的影响物资溶解性的因素是。
四、推断题
-
15. 以化合价为纵坐标,物质类别为横坐标所绘制的图象叫价类图,如图为碳的价类图,例如C点可能标示+2价的碳的氧化物,请回答:
 (1)、A点所表示的物质是天然气的主要成分,其化学式为。(2)、B点对应的物质类别是。(3)、D和水反应能生成E,化学方程式为 , 该反应属于基本反应类型中的。(4)、若F点表示的物质为含有4种元素的钠盐,该盐的用途有(任写一种)。(5)、查资料可知:元素处于最高价,只有氧化性:元素处于最低价,只有还原性,则CO可能具有的性质是。
(1)、A点所表示的物质是天然气的主要成分,其化学式为。(2)、B点对应的物质类别是。(3)、D和水反应能生成E,化学方程式为 , 该反应属于基本反应类型中的。(4)、若F点表示的物质为含有4种元素的钠盐,该盐的用途有(任写一种)。(5)、查资料可知:元素处于最高价,只有氧化性:元素处于最低价,只有还原性,则CO可能具有的性质是。五、流程题
-
16. 海洋是人类宝贵的自然资源,海水“制盐”体现了人类利用化学科学征服和改造自然的智慧。通过晾晒海水,可以得到粗盐,担盐中含有不溶性杂质(如泥沙等)和可溶性杂质(如MgCl2、CaCl2等),工业上以粗盐为原料制取精盐,其生产流程如图所示

请回答下列问题:
(1)、操作b中玻璃棒的作用是。(2)、加入Na2CO3溶液除去的离子是(填离子符号),加入NaOH溶液发生反应的化学方程式为;(3)、滤液中溶质的主要成分是(填化学式),加入足量稀盐酸的目的是。(4)、如果称量Ⅰ中称得粗盐的质量为3g,称量Ⅱ中称得精盐的质量为3.1g,则下列分析正确的是_____(填字母)A、精盐的产率为103.3% B、蒸发操作中可能有水分没有蒸干 C、除杂过程中有NaCl生成 D、溶解操作中粗盐没有完全溶解六、科学探究题
-
17. 在研究“酸碱中和反应”时,某兴趣小组同学想证明稀盐酸与氢氧化钠溶液混合后是否发生了化学反应,进行了如下探究:(1)、在盛有氢氧化的溶液的烧杯中入几滴酚酞溶液,再逐滴加入稀盐酸,并不断搅拌(如图一)。用数字化传感器测得盐酸与氢氧化钠溶液混合前后的温度变化情况(如图二)。

由实验现象和曲线变化情况分析可知,盐酸和氢氧化钠溶液发生了反应并(填“吸收”或“放出”)热量。
(2)、从微观角度分析盐酸与氢氧化钠溶液的反应
由如图可知,该反应的微观实质是。
(交流讨论)同学们讨论后认为,如果盐酸和氢氧化钠减少(或消失),或者有新物质生成,都能证明反应已经发生。
(3)、探究实验后烧杯中溶质的成分。步骤
现象
结论
实验1:取烧杯中的溶液少许于试管中,加入硫酸铜溶液
证明没有NaOH
实验2;另取烧杆中的溶液少许于试管中,加入硝酸银溶液
出现白色沉淀
证明含有HCl
实验3:再取烧杯中的溶液少许于蒸发皿中,加热蒸干
有产生
证明有NaCl生成
(得出结论)氢氧化钠溶液和盐酸发生了中和反应。
(4)、(评价反思)Ⅰ.有同学认为,仅通过实验2出“溶液中含有HCl”证据不足,理由是。
Ⅱ.运用中和反应,可以解决生产,生活中的实际同题。如工厂用氨水(NH3•H2O)处理废水中的硫酸,能得到一种氮肥一硫酸铵,写出该反应的化学方程式。
Ⅲ.多角度认识少学反应是学习化学的重变方法。
-
-
-