河南省南阳市内乡县2018-2019学年中考化学一模考试试卷
试卷更新日期:2019-08-05 类型:中考模拟
一、单选题
-
1. 下列制作过程中的变化属于化学变化的是( )A、粮食酿酒 B、石油分馏 C、铁水铸锅 D、麦磨成面2. “河南味道”名声远播。下列食品或食材中富含维生素的是( )A、原阳大米 B、叶县岩盐 C、西峡猕猴桃 D、道口烧鸡3. 发明了“联合制碱法”的科学家是( )A、
 侯德榜
B、
侯德榜
B、 拉瓦锡
C、
拉瓦锡
C、 门捷列夫
D、
门捷列夫
D、 张青莲
4. 空气中体积分数最大的气体是()
张青莲
4. 空气中体积分数最大的气体是()
A、氧气 B、氮气 C、二氧化碳 D、水蒸气5. 下列图示操作中错误的是( )A、 气密性检查
B、
气密性检查
B、 pH值测定
C、
pH值测定
C、 浓硫酸稀释
D、
浓硫酸稀释
D、 滴加液体
6. 矿泉水中含有钙、镁、钾、钠等,这里的钙、镁、钾、钠指( )A、元素 B、原子 C、单质 D、分子7. 下列各组生活中常见物质,按混合物、单质顺序排列的是( )A、海水、干冰 B、冰水、水银 C、食醋、黄铜 D、石油、金刚石8. 如图是铝的原子结构示意图。下列说法错误的是( )
滴加液体
6. 矿泉水中含有钙、镁、钾、钠等,这里的钙、镁、钾、钠指( )A、元素 B、原子 C、单质 D、分子7. 下列各组生活中常见物质,按混合物、单质顺序排列的是( )A、海水、干冰 B、冰水、水银 C、食醋、黄铜 D、石油、金刚石8. 如图是铝的原子结构示意图。下列说法错误的是( ) A、铝元素位于第三周期 B、在化合物中铝通常显+3价 C、铝的相对原子质量为13 D、铝在反应中易失去电子9. 化学与人类健康密切相关。下列说法正确的是( )A、硬水经过滤后可软化 B、食用碘盐可预防骨质疏松 C、霉变大米经淘洗后可食用 D、控制油脂摄入可减少肥胖的发生10. 一定温度下,向烧杯中加入一定质量的水,仅有部分晶体溶解.所得溶液与原溶液相比,说法正确的是( )
A、铝元素位于第三周期 B、在化合物中铝通常显+3价 C、铝的相对原子质量为13 D、铝在反应中易失去电子9. 化学与人类健康密切相关。下列说法正确的是( )A、硬水经过滤后可软化 B、食用碘盐可预防骨质疏松 C、霉变大米经淘洗后可食用 D、控制油脂摄入可减少肥胖的发生10. 一定温度下,向烧杯中加入一定质量的水,仅有部分晶体溶解.所得溶液与原溶液相比,说法正确的是( ) A、溶剂的质量增加,溶液颜色变浅 B、溶质溶解度不变,溶液颜色变深 C、溶质的质量增加,溶液颜色变深 D、溶质溶解度不变,溶液颜色不变11. 实验室测定蜡烛在盛有一定体积空气的密闭容器内燃烧至熄灭过程中,O2和CO含量随时间变化曲线如图,通过分析该图可推理出的结论是( )
A、溶剂的质量增加,溶液颜色变浅 B、溶质溶解度不变,溶液颜色变深 C、溶质的质量增加,溶液颜色变深 D、溶质溶解度不变,溶液颜色不变11. 实验室测定蜡烛在盛有一定体积空气的密闭容器内燃烧至熄灭过程中,O2和CO含量随时间变化曲线如图,通过分析该图可推理出的结论是( )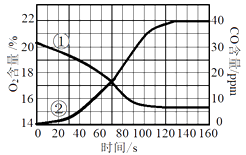 A、曲线①表示CO含量的变化 B、蜡烛发生了不完全燃烧 C、蜡烛由碳、氢元素组成 D、蜡烛熄灭时,容器内氧气耗尽12. 下列溶液在空气中敞口放置后,溶液质量因发生化学反应而增大的是()A、石灰水 B、浓硫酸 C、浓盐酸 D、烧碱溶液13. 将锌粉加入到一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,可以得到溶液和固体。下列说法错误的是( )A、固体中只有Ag时,滤液一定是蓝色的 B、固体中有Ag和Cu时,滤液中一定含有Zn(NO3)2和AgNO3 C、一定发生的反应是:Zn+2 AgNO3=Zn(NO3)2+2Ag D、随着锌粉的加入溶液的质量先减小后增大14. 某合金2g与足量的稀硫酸充分反应后,如果生成0.2g氢气,该合金中的元素可能是( )A、Zn和Fe B、Zn和Cu C、Cu和Au D、Mg和Al
A、曲线①表示CO含量的变化 B、蜡烛发生了不完全燃烧 C、蜡烛由碳、氢元素组成 D、蜡烛熄灭时,容器内氧气耗尽12. 下列溶液在空气中敞口放置后,溶液质量因发生化学反应而增大的是()A、石灰水 B、浓硫酸 C、浓盐酸 D、烧碱溶液13. 将锌粉加入到一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,可以得到溶液和固体。下列说法错误的是( )A、固体中只有Ag时,滤液一定是蓝色的 B、固体中有Ag和Cu时,滤液中一定含有Zn(NO3)2和AgNO3 C、一定发生的反应是:Zn+2 AgNO3=Zn(NO3)2+2Ag D、随着锌粉的加入溶液的质量先减小后增大14. 某合金2g与足量的稀硫酸充分反应后,如果生成0.2g氢气,该合金中的元素可能是( )A、Zn和Fe B、Zn和Cu C、Cu和Au D、Mg和Al二、填空题
-
15. 化学知识在生产、生活中有着广泛的应用(1)、用洗洁精除去油污,是由于洗洁精对油污有作用。(2)、保险丝(铅锑合金)比组成它的纯金属的熔点。(3)、尼龙手套、玻璃茶杯、纯棉桌布中,主要用有机合成材料制成的是。16. 农药波尔多液是由石灰乳和硫酸铜配制而成,硫酸铜的构成微粒有Cu2+和;防毒面具的滤毒罐里常用来吸附毒气。17. 如图是甲、乙两种固体的溶解度曲线。将t3℃时相同质量的甲、乙两种物质的饱和溶液降温到t1℃,只有甲的溶液中有固体50g析出,则甲的溶解度曲线为(填“X“或“Y“);t1℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量乙的质量(填“大于”、“小于”或“等于”); t3℃时,将75g甲的饱和溶液稀释为质量分数为20%的溶液,需加水的质量为g。
 18. 如图是治理汽车尾气反应的微观过程。
18. 如图是治理汽车尾气反应的微观过程。 (1)、图中有种氧化物。(2)、写出该反应的化学方程式。
(1)、图中有种氧化物。(2)、写出该反应的化学方程式。三、简答题
-
19. 煤块经粉碎处理后,在空气中燃烧得更快、更充分,这是因为;高压水枪灭火所依据的灭火原理是;氢气作燃料的优点是(答出一条即可)。20. 在点燃条件下,4.8g CH4与16.0g O2恰好完全反应,生成10.8gH2O、4.4g CO2和物质X.则X的质量为g;化学方程式为。21. 某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象,取反应后的部分溶液测其酸碱度、加热、蒸干、得到白色固体。已知CaCl2溶液呈中性。(1)、怎样用pH试纸测定反应后溶液的酸碱度?(2)、若得到的白色固体为CaCl2 , 请分析反应后溶液中溶质成分。22. 为了除去粗盐中CaCl2、MgCl2、Na2SO4等可溶性杂质,需进行如下操作:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量盐酸;⑤蒸发、结晶[提示:Mg(OH)2、BaSO4、BaCO3难溶于水;微溶物不形成沉淀;Na2CO3溶液星碱性](1)、加入Na2CO3溶液的目的是什么?(2)、最后制得氯化钠的质量大于粗盐中氯化钠的质量,写出一个可使氯化钠质量增加的化学方程式。(3)、请设计实验方案证明操作③所得溶液中含有NaOH。(写出实验步骤和现象)
四、推断题
-
23. 甲、乙、丙、丁是常见的化合物,它们有如图所示转化关系(部分物质已略去),甲是实验室常用燃料,其相对分子质量为46的有机物;乙是最常见的溶剂;丁是白色难溶固体,可做补钙剂。则甲的化学式为;反应③的化学方程式为;试剂A中溶质在生产或生活中的一种用途是。

五、流程题
-
24. 为减少污染并变废为宝,一化学兴趣小组在实验室探究工业废水的综合利用,设计了以下流程图并完成了回收铜和硫酸亚铁晶体的实验。
 (1)、A的成分为。(2)、写出②所发生反应的化学方程式为。(3)、操作a和操作b中都要用到一种玻璃仪器。该仪器在操作b中的作用是什么?
(1)、A的成分为。(2)、写出②所发生反应的化学方程式为。(3)、操作a和操作b中都要用到一种玻璃仪器。该仪器在操作b中的作用是什么?六、综合题
-
25. 化学是以实验为基础的科学,实验是科学探究的重要手段。(1)、某化学兴趣小组的同学利用图1微型实验装置进行探究实验。①挤压滴管后,写出单球管中发生反应的化学方程式。

②点燃系在细铁丝下的火柴,待火柴快燃烧尽时立即插入充满氧气的集气管中并塞紧,观察到的实验现象是。
③采用微型实验装置的优点有哪些?(答出一条即可)
(2)、另一化学兴趣小组选用图2装置制取纯净、干燥的CO2 , 并验证其部分性质。①B装置中发生反应的化学方程式为。
②C装置中浓硫酸的作用是。
③请在D中简要补画出CO2的收集装置图。
④要证明在E装置中CO2与NaOH溶液发生了反应,应如何操作?(写出实验步骤和现象)
(3)、将30g氯酸钾(KClO3)和二氧化锰的固体混合物装入试管中,加热制取氧气,同时生成氯化钾。待反应完全后,将试管冷却,称量,可以得到20.4g固体物质。请计算原固体混合物中氯酸钾的质量。
-
-