山西省长治市上党联盟2018-2019学年高一下学期化学期末考试试卷
试卷更新日期:2019-08-01 类型:期末考试
一、选择题(本题包括16小题,每小题3分,共48分。)
-
1. 保护环境,人人有责。下列做法不应该提倡的是( )A、将废旧电池埋在地下,防止污染 B、对煤进行脱硫处理,减少SO2的排放 C、对生活垃圾进行分类处理 D、开发新能源,减少化石燃料的使用2. 下列说法正确的是( )A、H2O与H2O2是同种物质 B、 和 互为同素异形体 C、红磷与白磷互为同系物 D、正戊烷和异戊烷互为同分异构体3. 下列物质中,属于只含有离子键的离子化合物的是( )A、Na2O B、Ca(OH)2 C、HF D、CO24. 工业上利用氨的催化氧化法制备硝酸,生成一氧化氮的反应为 ,已知该反应为放热反应,下列有关该反应的说法正确的是( )
A、该反应历程中所有过程都是放热过程 B、4 mol NH3和5 mol O2的总能量小于4molNO和6molH2O的总能量 C、氧化剂和还原剂的物质的量之比为4:5 D、该反应中所涉及的物质均只含共价键5. 下列有关化学用语表示正确的是( )A、异戊烷的分子式: B、 的结构示意图: C、乙烯的结构式C2H4
D、甲烷的比例模型
C、乙烯的结构式C2H4
D、甲烷的比例模型  6. 下列混合物的分离提纯方法正确的是( )
6. 下列混合物的分离提纯方法正确的是( )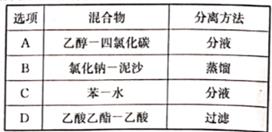 A、A B、B C、C D、D7. 生活中很多方面都涉及化学反应,下列应用中不涉及氧化还原反应的是( )A、乙酸除水垢 B、粮食酿酒 C、钢铁的腐蚀 D、光合作用8. 下列关于食物中的基本营养物质的叙述不正确的是( )A、葡萄糖和果糖都不能发生水解反应 B、油脂在酸性条件下的水解反应称为皂化反应 C、淀粉和纤维素都是天然高分子化合物 D、蛋白质在酶的催化作用下水解生成氨基酸9. 实验室由海水获得淡水的实验装置是( )A、
A、A B、B C、C D、D7. 生活中很多方面都涉及化学反应,下列应用中不涉及氧化还原反应的是( )A、乙酸除水垢 B、粮食酿酒 C、钢铁的腐蚀 D、光合作用8. 下列关于食物中的基本营养物质的叙述不正确的是( )A、葡萄糖和果糖都不能发生水解反应 B、油脂在酸性条件下的水解反应称为皂化反应 C、淀粉和纤维素都是天然高分子化合物 D、蛋白质在酶的催化作用下水解生成氨基酸9. 实验室由海水获得淡水的实验装置是( )A、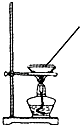 B、
B、 C、
C、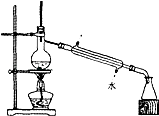 D、
D、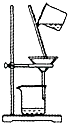 10. 下列有机物能发生加成反应的是( )A、聚乙烯 B、CH3CH=CH2 C、CH3CH2CH3 D、乙醇11. 向体积为2L的密闭容器中通入2 mol A和2mol B,发生反应2A+B 2C,下列有关说法正确的是( )A、反应达到平衡时生成2 mol C B、扩大容器体积,反应速率增大 C、若升高温度,化学反应速率增大,则该反应为放热反应 D、达到平衡时,C的正逆反应速率相等12. 酒石酸是葡萄酒中主要的有机酸之一,其结构如图所示。下列关于酒石酸的说法不正确的是( )
10. 下列有机物能发生加成反应的是( )A、聚乙烯 B、CH3CH=CH2 C、CH3CH2CH3 D、乙醇11. 向体积为2L的密闭容器中通入2 mol A和2mol B,发生反应2A+B 2C,下列有关说法正确的是( )A、反应达到平衡时生成2 mol C B、扩大容器体积,反应速率增大 C、若升高温度,化学反应速率增大,则该反应为放热反应 D、达到平衡时,C的正逆反应速率相等12. 酒石酸是葡萄酒中主要的有机酸之一,其结构如图所示。下列关于酒石酸的说法不正确的是( )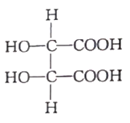 A、能发生取代反应 B、分子式为C4H6O5 C、1 mol酒石酸能和4mol NaOH完全反应 D、能发生氧化反应13. 我国成功研制出新型“海水电池”,电池反应为4Al+3O2+6H2O=4Al(OH)3。下列关于该电池的说法不正确的是( )
A、能发生取代反应 B、分子式为C4H6O5 C、1 mol酒石酸能和4mol NaOH完全反应 D、能发生氧化反应13. 我国成功研制出新型“海水电池”,电池反应为4Al+3O2+6H2O=4Al(OH)3。下列关于该电池的说法不正确的是( )
A、电池工作时,O2得到电子 B、电池工作时,实现了化学能向电能的转化 C、电池工作时,铝片发生氧化反应 D、电池工作时,电子在电解质溶液中移动14. X,Y,Z,W是原子序数依次增大的短周期主族元素,X的一种单质是目前地球上发现的最坚硬的天然物质,Y和X相邻,Z元素原子的最外层只有一个电子,W的单质在常温下是一种黄绿色气体。下列说法正确的是( )
A、X的最高价氧化物对应水化物的酸性在同周期中最强 B、Y只能形成一种氧化物 C、W的单质可以用作自来水的消毒剂 D、Z的最高价氧化物对应的水化物是一种弱碱15. 钢铁在潮湿的空气中会形成原电池发生腐蚀:一种腐蚀称为吸氧腐蚀,总反应式为 另一种腐蚀称为析氢腐蚀,总反应式为 下列有关说法正确的是( )A、两种类型的腐蚀都是由电能转化为化学能 B、两种类型的腐蚀中,铁都作负极,发生还原反应 C、析氢腐蚀时,生成1molH2同时转移1mol电子 D、发生腐蚀时,铁中含有的碳作为正极16. 某有机物的分子式为 其同分异构体的数目为(不考虑立体异构)( )A、1种 B、2种 C、3 D、4种二、非选择题(本题包括5小题,共52分)
-
17. 溴苯是一种无色油状液体,具有苯的气味,不溶于水,溶于甲醇、乙醚、丙酮等多数有机溶剂,工业上主要用于充当溶剂、分析试剂和用于有机合成等。实验室用如图所示装置制质的部分物理性质如下表所示,回答下列相关问题。
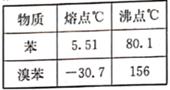 (1)、裝苯和溴的仪器名称是 , 烧杯中倒扣的漏斗的作用是
(1)、裝苯和溴的仪器名称是 , 烧杯中倒扣的漏斗的作用是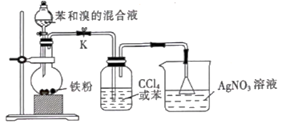 (2)、烧瓶中加入铁粉的目的是和液溴反应生成催化剂FeBr3 , 写出生成FeBr3反应的化学方程式:烧杯中能观察到的实验现象是
(2)、烧瓶中加入铁粉的目的是和液溴反应生成催化剂FeBr3 , 写出生成FeBr3反应的化学方程式:烧杯中能观察到的实验现象是
(3)、写出苯和溴反应的化学方程式: , 该反应的反应类型是(4)、根据题中信息,分离苯和溴苯的实验操作是18. 研究化学反应中的能量和速率变化对生产生活有着重要意义。(1)、某同学为探究反应Fe+H2SO4(稀)=FeSO4+H2 中的能量变化,向装有铁片的试管中滴加稀H2SO4 , 试管内产生气泡,触摸试管外壁,温度升高。①该反应为(填“放热”或“吸热”)反应,因此在该反应中,断裂化学键吸收的能(填“大于”或“小于”)形成化学键放出的能量。
②下列措施中,能加快氢气生成速率的是(填字母)。
a.将铁片改成铁粉
b.降低稀H2SO4的温度
(2)、微生物电池是指在微生物作用下将化学能转化为电能的装置,总反应的化学方程式为 其工作原理如图所示,回答下列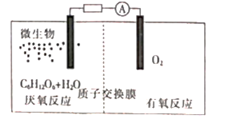
①有氧反应一极是电池的(填“正”或“负”)极,质子交换膜允许 通过,该电池的正极反应式为
②若该电路中转移电子的物质的量为12 mol,则生成CO2的体积(标准状况)为
19. 海带中提取碘的一种流程如下: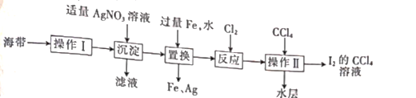
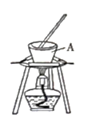 (1)、操作Ⅰ的主要目的是获得含 的溶液,他包括灼烧、水浸。其中灼烧用的装置如图所示,仪器A的名称为(2)、若“反应”中通入的Cl2恰好将 转化为 ,则该反应的离子方程式为 , 由此可以证明Cl2的氧化性(填“强”或“弱”)于
(1)、操作Ⅰ的主要目的是获得含 的溶液,他包括灼烧、水浸。其中灼烧用的装置如图所示,仪器A的名称为(2)、若“反应”中通入的Cl2恰好将 转化为 ,则该反应的离子方程式为 , 由此可以证明Cl2的氧化性(填“强”或“弱”)于
(3)、操作Ⅱ的现象是;得到水层的方法:将通入Cl2后的溶液置于分液漏斗中,加人CCl4 , 振荡静置,(4)、检验“操作Ⅱ”所得水层中是否含有 的方法是20. 乙烯是来自煤和石油的重要化工原料。在一定条件下可发生下列转化: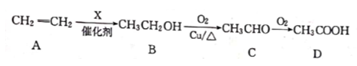 (1)、对比A,B的结构,X的名称是 , D中含有官能团的名称为(2)、写出B与D在浓H2SO4作用下共热反应的化学方程式:(3)、A分子之间也可相互反应生成聚乙烯,写出该反应的化学方程式:。下列有关聚乙烯的说法正确的是(填字母)。
(1)、对比A,B的结构,X的名称是 , D中含有官能团的名称为(2)、写出B与D在浓H2SO4作用下共热反应的化学方程式:(3)、A分子之间也可相互反应生成聚乙烯,写出该反应的化学方程式:。下列有关聚乙烯的说法正确的是(填字母)。a可以发生加成反应
b.是高分子化合物
c单体是CH3CH3
21. 某化学课外活动小组设计了如图所示的装置(图中夹持装置未画出,“△”表示酒精灯热源)来研究乙醇催化氧化的实验。已知:无水乙醇的沸点为78℃,新制氢氧化铜悬浊液可用于验证乙醇催化氧化反应的氧化产物。 (1)、发生反应时,装置A中反应的还原剂是(填化学式,下同),D中反应的氧化剂是(2)、装置B的作用是;装置C中热水的作用是(3)、装置D中发生的氧化反应的化学方程式为(4)、实验一段时间后,若撤掉装置D中的酒精灯,则反应(填“能”或“不能”)继续进行,原因是
(1)、发生反应时,装置A中反应的还原剂是(填化学式,下同),D中反应的氧化剂是(2)、装置B的作用是;装置C中热水的作用是(3)、装置D中发生的氧化反应的化学方程式为(4)、实验一段时间后,若撤掉装置D中的酒精灯,则反应(填“能”或“不能”)继续进行,原因是