山东省潍坊市2018-2019学年高二下学期化学期末考试试卷
试卷更新日期:2019-08-01 类型:期末考试
一、选择题(本题包括14小题,每小题3分,共42分)
-
1. 丝绸是纺织品里的“贵族”,是蚕丝织品的总称。下列有关说法错误的是( )A、蚕丝的主要成分为蛋白质 B、蚕丝制品可用强碱性的洗涤剂洗涤 C、仿毛织品的成分聚丙烯腈(
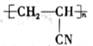 )的单体为CH2=CH-CN
D、棉织品由天然的植物纤维素加工制造而成,成分属于糖类
2. 化学与生活生产息息相关,下列说法错误的是( )A、用可见光束照射能区别溶液和胶体 B、小苏打可用作焙制糕点的发酵粉 C、盐碱地(含较多Na2CO3,)不利于作物生长,可施加熟石灰进行改良 D、将废铁屑加入FeCl2溶液中可用于除去工业废气中的Cl23. 下列说法错误的是( )A、丙烯在一定条件下可以发生取代反应 B、正戊烷的沸点比新戊烷的高 C、用甘氨酸和丙氨酸缩合最多可以形成4种二肽 D、油脂的皂化是高分子生成小分子的过程4. NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、 FeCl3 , 溶液制备胶体,得到Fe(OH)3 , 胶粒的数目为NA B、2.24L CL2与足量的铁粉发生反应转移的电子数为0.3N, C、 1L. 12mL L.浓盐酸与足量的MnO2充分反应制得Cl2的分子数为3NA D、1mol HCOOCH3分子中含有C-H键的数目为4NA5. 下列有关化学反应的叙述,正确的是( )A、常温下Fe与浓硫酸反应生成硫酸铁、SO2和H2O B、钠切割后表面变暗,反应生成Na2O2 C、苯酚悬浊液中加入Na2CO3溶液,反应生成NaHCO3和苯酚钠 D、140℃时液H2SO4与乙醇反应生成乙烯和水6. 下列反应过程对应的离子方程式正确的是( )A、重铬酸钾用于测酒驾: B、碱性溶液中, KClO与Fe( OH)3反应制备净水剂K2FeO4 C、侯德榜制碱的原理 NH3+ H2O+CO2+ NaCl=NH +Cl-+NaHCO D、硫代硫酸钠(Na2S2O3)可用作脱氯剂:7. 离子交换法净化水过程如图所示。下列说法中错误的是( )
)的单体为CH2=CH-CN
D、棉织品由天然的植物纤维素加工制造而成,成分属于糖类
2. 化学与生活生产息息相关,下列说法错误的是( )A、用可见光束照射能区别溶液和胶体 B、小苏打可用作焙制糕点的发酵粉 C、盐碱地(含较多Na2CO3,)不利于作物生长,可施加熟石灰进行改良 D、将废铁屑加入FeCl2溶液中可用于除去工业废气中的Cl23. 下列说法错误的是( )A、丙烯在一定条件下可以发生取代反应 B、正戊烷的沸点比新戊烷的高 C、用甘氨酸和丙氨酸缩合最多可以形成4种二肽 D、油脂的皂化是高分子生成小分子的过程4. NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、 FeCl3 , 溶液制备胶体,得到Fe(OH)3 , 胶粒的数目为NA B、2.24L CL2与足量的铁粉发生反应转移的电子数为0.3N, C、 1L. 12mL L.浓盐酸与足量的MnO2充分反应制得Cl2的分子数为3NA D、1mol HCOOCH3分子中含有C-H键的数目为4NA5. 下列有关化学反应的叙述,正确的是( )A、常温下Fe与浓硫酸反应生成硫酸铁、SO2和H2O B、钠切割后表面变暗,反应生成Na2O2 C、苯酚悬浊液中加入Na2CO3溶液,反应生成NaHCO3和苯酚钠 D、140℃时液H2SO4与乙醇反应生成乙烯和水6. 下列反应过程对应的离子方程式正确的是( )A、重铬酸钾用于测酒驾: B、碱性溶液中, KClO与Fe( OH)3反应制备净水剂K2FeO4 C、侯德榜制碱的原理 NH3+ H2O+CO2+ NaCl=NH +Cl-+NaHCO D、硫代硫酸钠(Na2S2O3)可用作脱氯剂:7. 离子交换法净化水过程如图所示。下列说法中错误的是( ) A、经过阳离子交换树脂后,水中阳离子的总数减少 B、阴离子树脂吸附1mol 后,交换出2mol OH- C、通过净化处理后,水的导电性降低 D、阴离子树脂填充段存在反应8. 实验室制备漠苯的反应装置(加热和夹持装置略去)如下图所示,下列叙述正确的是( )
A、经过阳离子交换树脂后,水中阳离子的总数减少 B、阴离子树脂吸附1mol 后,交换出2mol OH- C、通过净化处理后,水的导电性降低 D、阴离子树脂填充段存在反应8. 实验室制备漠苯的反应装置(加热和夹持装置略去)如下图所示,下列叙述正确的是( ) A、关闭K,向三颈烧瓶中滴加苯和溴的混合液,然后加热装置a B、实验中装置b中的液体会出现明显分层 C、反应后取少量c中溶液加入硝酸酸化的AgNO3 , 溶液生成白色沉淀 D、反应后装置a中的混合液经稀NaOH溶液洗涤、过滤、分液、蒸馏,得到溴苯9. 茅苍术醇是合成中草药的活性成分,其结构如图所示。下列说法正确的是( )
A、关闭K,向三颈烧瓶中滴加苯和溴的混合液,然后加热装置a B、实验中装置b中的液体会出现明显分层 C、反应后取少量c中溶液加入硝酸酸化的AgNO3 , 溶液生成白色沉淀 D、反应后装置a中的混合液经稀NaOH溶液洗涤、过滤、分液、蒸馏,得到溴苯9. 茅苍术醇是合成中草药的活性成分,其结构如图所示。下列说法正确的是( ) A、该物质的分子式为 B、该物质能与NaOH溶液发生反应 C、在一定条件下,该物质可以发生消去反应 D、该物质可以是酚类物质的同分异构体10. 下列分离物质(括号内的物质为杂质)的试剂和方法正确的是( )
A、该物质的分子式为 B、该物质能与NaOH溶液发生反应 C、在一定条件下,该物质可以发生消去反应 D、该物质可以是酚类物质的同分异构体10. 下列分离物质(括号内的物质为杂质)的试剂和方法正确的是( ) A、A B、B C、C D、D11. 双氢青蒿素的抗疟疗效是青蒿素的10倍,可由香草醛经过如下系列反应合成,
A、A B、B C、C D、D11. 双氢青蒿素的抗疟疗效是青蒿素的10倍,可由香草醛经过如下系列反应合成,下列说法错误的是( )
 A、一定条件下,香草醛与HCHO能发生缩合聚合反应 B、可用NaHCO3溶液鉴别香草醛和青蒿酸 C、利用红外光谱能鉴别出青蒿酸和青蒿素 D、青蒿素生成双氢青蒿素发生的是还原反应12. 早在1984年我国科学家就用自洽场近似分子轨道法HAM/3程序计算了若干典型的发柱烷和立方烷等的电子结构。下列有关说法中错误的是( )
A、一定条件下,香草醛与HCHO能发生缩合聚合反应 B、可用NaHCO3溶液鉴别香草醛和青蒿酸 C、利用红外光谱能鉴别出青蒿酸和青蒿素 D、青蒿素生成双氢青蒿素发生的是还原反应12. 早在1984年我国科学家就用自洽场近似分子轨道法HAM/3程序计算了若干典型的发柱烷和立方烷等的电子结构。下列有关说法中错误的是( ) A、a与b均是苯的同分异构体 B、a与d互为同系物 C、a、c、d的二氯代物均有3种 D、b、c都能使漠水褪色13. 某酯可用作聚氯乙烯、聚醋酸乙烯酯等多种树脂的增塑剂,分子式为
A、a与b均是苯的同分异构体 B、a与d互为同系物 C、a、c、d的二氯代物均有3种 D、b、c都能使漠水褪色13. 某酯可用作聚氯乙烯、聚醋酸乙烯酯等多种树脂的增塑剂,分子式为1mol该酯完全水解可得到2mol羧酸和1mol乙二醇,该羧酸的分子式为( )
A、 B、 C、 D、14. 过碳酸钠具有碳酸钠和双氧水的性质,主要用作漂白剂、杀菌剂、去污剂等。一种利用碳酸钠和过氧化氢反应制备过碳酸钠固体的工艺如下。下列说法错误的是( ) A、反应釜中的主要反应为 B、过碳酸钠可用作漂白剂主要利用了碳酸钠溶液的碱性 C、硫酸镁和硅酸钠混合物作稳定剂,防止 分解 D、过碳酸钠遇石灰水反应变质
A、反应釜中的主要反应为 B、过碳酸钠可用作漂白剂主要利用了碳酸钠溶液的碱性 C、硫酸镁和硅酸钠混合物作稳定剂,防止 分解 D、过碳酸钠遇石灰水反应变质二、非选择题
-
15. 绿水青山就是金山银山,我国的废水处理再利用技术有了重大突破。(1)、含高浓度CN-的废水可用多硫化物MS4溶液在碱性条件下处理, CN-被氧化成毒性较小的SCN- , 转为化 ,写出该反应的离子方程式(2)、含有NaCN的废水还常用Ca(ClO)2 , 处理,使其最终转化为无害物质。其反应如下:
反应Ⅰ.Ca(ClO)2+2H2O=Ca(OH)2+2HClO
反应Ⅱ.2NaCN+2HClO+Ca(OH)2=2NaCNO +2H2O +CaCl2(CNO-中C为+4)
反应Ⅲ.NaCNO+HClO- +H2 +N2 +NaCl(未配平)
①反应Ⅱ中氧化剂是(写化学式),氧化产物与还原产物的物质的量之比
为。
②若反应Ⅲ中转移0.6mol电子,则生成的气体在标准状况下的总体积是
(3)、工业还可用硝酸铜和柠檬酸为原料,以CuO为催化剂,催化氧化处理含高浓度CN-的废水。CN-去除率与搅拌速率、时间和pH的关系如下图所示,由图可知,在相同时间内最佳反应条件为。分析pH>6时CN去除率降低的原因(用相关的离子方程式和文字说明) 16. 由碳、氢、氧3种元素组成的有机物A,氧元素的质量分数为16%,A的种同分异构体的质谱图如下图所示。(已知有机物中双键碳原子不能与-OH直接相连)
16. 由碳、氢、氧3种元素组成的有机物A,氧元素的质量分数为16%,A的种同分异构体的质谱图如下图所示。(已知有机物中双键碳原子不能与-OH直接相连)
回答下列问题:
(1)、A的相对分子质量是(2)、由A生成高分子化合物E的一种流程如下图所示: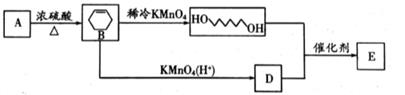
①A的化学名称为
②生成E的化学方程式为
(3)、A有多种同分异构体能与金属钠反应放出H2。其中分子内所有碳原子在同一个平面上的A的结构简式为分子中存在 ,且存在顺反异构体的A的反式异构体的结构简式为
(4)、碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子。若A分子中存在“-OH”、“
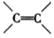 ”和两个“ ”,且分子中存在两个手性碳原子。则A的结构简式为17. 氯酸钾是一种重要的氧化剂,受热易分解。为充分利用资源,变废为宝,实验室以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下
”和两个“ ”,且分子中存在两个手性碳原子。则A的结构简式为17. 氯酸钾是一种重要的氧化剂,受热易分解。为充分利用资源,变废为宝,实验室以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下
回答下列问题:
(1)、加热下氯化过程发生反应的化学方程式为(2)、为保证氯化过程中Cl2反应充分,制Cl2时应采取的措施是 , 导气口n后所连接装置合适的是(填序号)。 (3)、操作2包含一系列实验操作,主要为→降温结晶→过滤→洗涤→低温干燥。(4)、下图是制备过程中处理尾气的部分装置。
(3)、操作2包含一系列实验操作,主要为→降温结晶→过滤→洗涤→低温干燥。(4)、下图是制备过程中处理尾气的部分装置。
①B中溶液为
②A中装有蒸馏水,查阅资料可知次氯酸或氯气可被SO2 , H2O2 , FeCl2等物质还原成Cl- , 请设计实验方案测定A中氯元素含量
18. 钒、铁、铝及其化合物在生产生活中应用广泛,为了变废为宝,充分利用资源,用含钒灰渣(成分有 、 、FeO, Al2O3 , SiO2等)提取五氧化二钒及铵明矾和铁红,具体工艺如下:
回答下列问题:
(1)、滤渣中的主要成分是(2)、用硫酸溶解渣粉时 转化为 VO2+ 反应的离子方程式为(3)、KClO3与Fe2+反应的离子方程式为(4)、粗铵明矾纯化采取的操作名称是(5)、采用热重分析法测定铵明矾[NH4Al(SO4)2. XH2O]所含结晶水数,将1mol晶体加热到120℃时,失掉18g结晶水,失重3.97%,硫酸铝铵晶体的化学式为(6)、研究小组探究制得的铁红中是否含有Fe2+ , 正确的操作是可选试剂:稀硫酸、稀盐酸、KSCN溶液、KMnO4溶液、NaOH溶液
19. 普罗巴酮为广谱高效膜抑制性心律失常药。一种合成普罗巴酮的路线如下:
回答下列问题:
(1)、H中含氧官能团的名称为 , F→G的反应类型为(2)、化合物E的结构简式为(3)、写出苯甲醛与新制Cu(OH)2反应的化学方程式(4)、能发生银镜反应且苯环上有两个取代基的D的同分异构体有种,(不考虑立体异构),其中核磁共振氢谱有4组峰且峰面积之比为3:2:2:1的异构体的结构简式为(写出一种即可)。(5)、兔耳草醛( )是一种重要的香料。设计由对异丙基苯甲醇和丙醛制备兔耳草醛的合成路线(无机试剂任选):
)是一种重要的香料。设计由对异丙基苯甲醇和丙醛制备兔耳草醛的合成路线(无机试剂任选):