2017年高考化学真题试卷(天津卷)(正式版)
试卷更新日期:2017-06-12 类型:高考真卷
一、本卷共6题,每题6分,共36分.在每题给出的四个选项中,只有一项是最符合题目要求的.
-
1. 下列有关水处理方法不正确的是( )A、用石灰、碳酸钠等碱性物质处理废水中的酸 B、用可溶性的铝盐和铁盐处理水中的悬浮物 C、用氯气处理水中的Cu2+、Hg+等重金属离子 D、用烧碱处理含高浓度NH4+的废水并回收利用氨2.
汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用.下列有关汉黄芩素的叙述正确的是( )
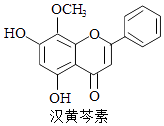 A、汉黄芩素的分子式为C16H13O5 B、该物质遇FeCl3溶液显色 C、1 mol该物质与溴水反应,最多消耗1mol Br2 D、与足量H2发生加成反应后,该分子中官能团的种类减少1种3. 下列能量转化过程与氧化还原反应无关的是( )A、硅太阳能电池工作时,光能转化成电能 B、锂离子电池放电时,化学能转化成电能 C、电解质溶液导电时,电能转化成化学能 D、葡萄糖为人类生命活动提供能量时,化学能转化成热能4. 以下实验设计能达到实验目的是( )
A、汉黄芩素的分子式为C16H13O5 B、该物质遇FeCl3溶液显色 C、1 mol该物质与溴水反应,最多消耗1mol Br2 D、与足量H2发生加成反应后,该分子中官能团的种类减少1种3. 下列能量转化过程与氧化还原反应无关的是( )A、硅太阳能电池工作时,光能转化成电能 B、锂离子电池放电时,化学能转化成电能 C、电解质溶液导电时,电能转化成化学能 D、葡萄糖为人类生命活动提供能量时,化学能转化成热能4. 以下实验设计能达到实验目的是( )实验目的
实验设计
A.
除去NaHCO3固体中的Na2CO3
将固体加热至恒重
B.
制备无水AlCl3
蒸发Al与稀盐酸反应后的溶液
C.
重结晶提纯苯甲酸
将粗品水溶、过滤、蒸发、结晶
D.
鉴别NaBr和KI溶液
分别加新制氯水后,用CCl4萃取
A、A B、B C、C D、D5. 根据元素周期表和元素周期律,判断下列叙述不正确的是( )A、气态氢化物的稳定性:H2O>NH3>SiH4 B、氢元素与其他元素可形成共价化合物或离子化合物 C、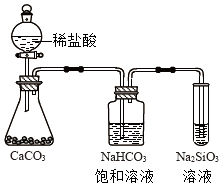 如图所示实验可证明元素的非金属性:Cl>C>Si
D、用中文“
如图所示实验可证明元素的非金属性:Cl>C>Si
D、用中文“ ”(ào)命名的第118号元素在周期表中位于第七周期0族
6. 常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)⇌Ni(CO)4(g).230℃时,该反应的平衡常数K=2×10﹣5 . 已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应.
”(ào)命名的第118号元素在周期表中位于第七周期0族
6. 常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)⇌Ni(CO)4(g).230℃时,该反应的平衡常数K=2×10﹣5 . 已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应.第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍.
下列判断正确的是( )
A、增加c(CO),平衡向正向移动,反应的平衡常数增大 B、第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ C、第二阶段,Ni(CO)4分解率较低 D、该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)二、本卷共4题,共64分.
-
7.
(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4 . 考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)、反应①所加试剂NaOH的电子式为 . B→C的反应条件为 , C→Al的制备方法称为 .(2)、该小组探究反应②发生的条件.D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2 . 由此判断影响该反应有效进行的因素有(填序号) .a.温度 b.Cl﹣的浓度 c.溶液的酸度
(3)、0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2•xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为 .Ⅱ含铬元素溶液的分离和利用
(4)、用惰性电极电解时,CrO42﹣能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式).8.(18分)2﹣氨基﹣3﹣氯苯甲酸(F)是重要的医药中间体,其制备流程图如下:
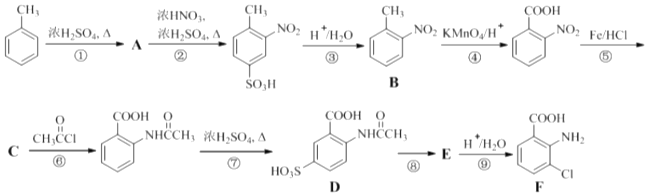
已知:
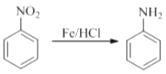
回答下列问题:
(1)、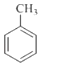 分子中不同化学环境的氢原子共有种,共面原子数目最多为 . (2)、B的名称为 . 写出符合下列条件B的所有同分异构体的结构简式 .
分子中不同化学环境的氢原子共有种,共面原子数目最多为 . (2)、B的名称为 . 写出符合下列条件B的所有同分异构体的结构简式 .a.苯环上只有两个取代基且互为邻位 b.既能发生银镜反应又能发生水解反应
(3)、该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,目的是 .(4)、写出⑥的化学反应方程式: , 该步反应的主要目的是 .(5)、写出⑧的反应试剂和条件:;F中含氧官能团的名称为 .(6)、在方框中写出以
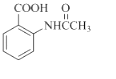 为主要原料,经最少步骤制备含肽键聚合物的流程.
为主要原料,经最少步骤制备含肽键聚合物的流程. … 目标化合物9. (18分)用沉淀滴定法快速测定NaI等碘化物溶液中c(I﹣),实验过程包括准备标准溶液和滴定待测溶液.
… 目标化合物9. (18分)用沉淀滴定法快速测定NaI等碘化物溶液中c(I﹣),实验过程包括准备标准溶液和滴定待测溶液.Ⅰ准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用.
b.配制并标定100mL 0.1000mol•L﹣1 NH4SCN标准溶液,备用.
Ⅱ滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中.
b.加入25.00mL 0.1000mol•L﹣1 AgNO3溶液(过量),使I﹣完全转化为AgI沉淀.
c.加入NH4Fe(SO4)2溶液作指示剂.
d.用0.1000mol•L﹣1NH4SCN溶液滴定过量的Ag+ , 使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定.
e.重复上述操作两次.三次测定数据如下表:
实验序号
1
2
3
消耗NH4SCN标准溶液体积/mL
10.24
10.02
9.98
f.数据处理.
回答下列问题:
(1)、将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有 .(2)、AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是 .(3)、滴定应在pH<0.5的条件下进行,其原因是 .(4)、b和c两步操作是否可以颠倒 , 说明理由 .(5)、所消耗的NH4SCN标准溶液平均体积为mL,测得c(I﹣)=mol•L﹣1 .(6)、在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为 .(7)、判断下列操作对c(I﹣)测定结果的影响(填“偏高”、“偏低”或“无影响”)①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果 .
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果 .
10. (14分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题.Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3═S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O
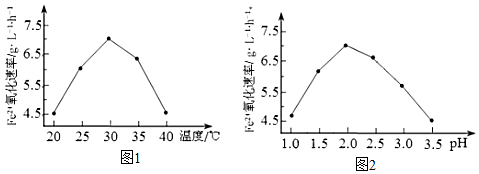
(1)、硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是 .(2)、由图1和图2判断使用硫杆菌的最佳条件为 . 若反应温度过高,反应速率下降,其原因是 .
 (3)、方法2:在一定条件下,用H2O2氧化H2S
(3)、方法2:在一定条件下,用H2O2氧化H2S随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同.当n(H2O2)/n(H2S)=4时,氧化产物的分子式为 .
(4)、Ⅱ.SO2的除去方法1(双碱法):用NaOH吸收SO2 , 并用CaO使NaOH再生
NaOH溶液 Na2SO3溶液
写出过程①的离子方程式:;CaO在水中存在如下转化:
CaO(s)+H2O (l)═Ca(OH)2(s)⇌Ca2+(aq)+2OH﹣(aq)
从平衡移动的角度,简述过程②NaOH再生的原理 .
(5)、方法2:用氨水除去SO2已知25℃,NH3•H2O的Kb=1.8×10﹣5 , H2SO3的Ka1=1.3×10﹣2 , Ka2=6.2×10﹣8 . 若氨水的浓度为2.0mol•L﹣1 , 溶液中的c(OH﹣)=mol•L﹣1 . 将SO2通入该氨水中,当c(OH﹣)降至1.0×10﹣7 mol•L﹣1时,溶液中的c(SO32﹣)/c(HSO3﹣)= .