2017年高考理综真题试卷(化学部分)(新课标Ⅲ卷)
试卷更新日期:2017-06-12 类型:高考真卷
一、选择题:本题共7个小题,每小题6分,共42分.在每小题给出的四个选项中,只有一项是符合题目要求的.
-
1. 化学与生活密切相关.下列说法错误的是( )A、PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物 B、绿色化学要求从源头上消除或减少生产活动对环境的污染 C、燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 D、天然气和液化石油气是我国目前推广使用的清洁燃料2. 下列说法正确的是( )A、植物油氢化过程中发生了加成反应 B、淀粉和纤维素互为同分异构体 C、环己烷与苯可用酸性KMnO4溶液鉴别 D、水可以用来分离溴苯和苯的混合物3. 下列实验操作规范且能达到目的是( )
目的
操作
A.
取20.00 mL盐酸
在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶
B.
清洗碘升华实验所用试管
先用酒精清洗,再用水清洗
C.
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
D.
配制浓度为0.010 的KMnO4溶液
称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度
A、A B、B C、C D、D4. NA为阿伏加德罗常数的值.下列说法正确的是( )A、0.1 mol 的11B中,含有0.6NA个中子 B、pH=1的H3PO4溶液中,含有0.1NA个H+ C、2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子 D、密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加2NA个P﹣Cl键5.全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )
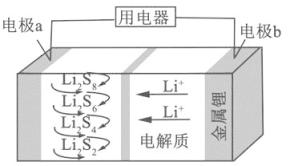 A、电池工作时,正极可发生反应:2Li2S6+2Li++2e﹣=3Li2S4 B、电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g C、石墨烯的作用主要是提高电极a的导电性 D、电池充电时间越长,电池中的Li2S2量越多6. 短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外电子数之和为21.下列关系正确的是( )
A、电池工作时,正极可发生反应:2Li2S6+2Li++2e﹣=3Li2S4 B、电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g C、石墨烯的作用主要是提高电极a的导电性 D、电池充电时间越长,电池中的Li2S2量越多6. 短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外电子数之和为21.下列关系正确的是( )W
X
Y
Z
A、氢化物沸点:W<Z B、氧化物对应水化物的酸性:Y>W C、化合物熔点:Y2X3<YZ3 D、简单离子的半径:Y<X7.在湿法炼锌的电解循环溶液中,较高浓度的Cl﹣会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4 , 生成CuCl沉淀从而除去Cl﹣ . 根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
 A、Ksp(CuCl)的数量级为10﹣7 B、除Cl﹣反应为Cu+Cu2++2Cl﹣=2CuCl C、加入Cu越多,Cu+浓度越高,除Cl﹣ . 效果越好 D、2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
A、Ksp(CuCl)的数量级为10﹣7 B、除Cl﹣反应为Cu+Cu2++2Cl﹣=2CuCl C、加入Cu越多,Cu+浓度越高,除Cl﹣ . 效果越好 D、2Cu+=Cu2++Cu平衡常数很大,反应趋于完全二、解答题(共3小题,满分43分)
-
8. (14分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途.某化学兴趣小组对绿矾的一些性质进行探究.回答下列问题:(1)、在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化.再向试管中通入空气,溶液逐渐变红.由此可知:、 .(2)、
为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验.
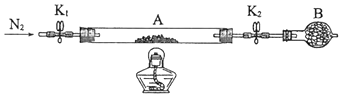
①仪器B的名称是 .
②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g.
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2e.称量Af.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示).若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”).
(3)、为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热.实验后反应管中残留固体为红色粉末.
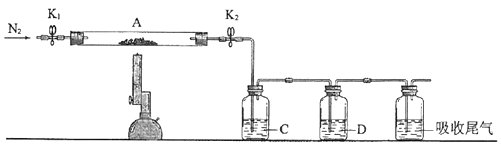
①C、D中的溶液依次为(填标号).C、D中有气泡冒出,并可观察到的现象分别为 .
a.品红b.NaOHc.BaCl2d.Ba(NO3)2e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式 .
9.(15分)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO•Cr2O3 , 还含有硅、铝等杂质.制备流程如图所示:
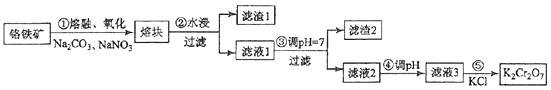
回答下列问题:
(1)、步骤①的主要反应为:FeO•Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeO•Cr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .(2)、滤渣1中含量最多的金属元素是 , 滤渣2的主要成分是及含硅杂质.(3)、步骤④调滤液2的pH使之变(填“大”或“小”),原因是(用离子方程式表示).(4)、有关物质的溶解度如图所示.
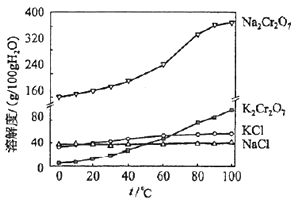
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体.冷却到(填标号)得到的K2Cr2O7固体产品最多.
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是 .
(5)、某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7 , 最终得到产品 m2 kg,产率为 .10. (14分)砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途.回答下列问题:(1)、画出砷的原子结构示意图 .(2)、工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫.写出发生反应的化学方程式 . 该反应需要在加压下进行,原因是 .(3)、已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s)△H1H2(g)+ O2(g)=H2O(l)△H2
2As(s)+ O2(g)=As2O5(s)△H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H= .
(4)、298K时,将20mL 3x mol•L﹣1 Na3AsO3、20mL 3x mol•L﹣1 I2和20mL NaOH溶液混合,发生反应:AsO33﹣(aq)+I2(aq)+2OH﹣⇌AsO43﹣(aq)+2I﹣(aq)+H2O(l).溶液中c(AsO43﹣)与反应时间(t)的关系如图所示.

①下列可判断反应达到平衡的是(填标号).
a.溶液的pH不再变化
b.v(I﹣)=2v(AsO33﹣)
c.c (AsO43﹣)/c (AsO33﹣)不再变化
d.c(I﹣)=y mol•L﹣1
②tm时,v正 v逆(填“大于”“小于”或“等于”).
③tm时v逆tn时v逆(填“大于”“小于”或“等于”),理由是 .
④若平衡时溶液的pH=14,则该反应的平衡常数K为 .
三、[化学--选修3:物质结构与性质]
-
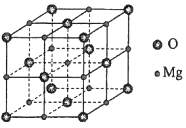
11. (15分)研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:(1)、Co基态原子核外电子排布式为 . 元素Mn与O中,第一电离能较大的是 , 基态原子核外未成对电子数较多的是 .(2)、CO2和CH3OH分子中C原子的杂化形式分别为和 .(3)、在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为 , 原因是 .(4)、硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在 .(5)、
MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2﹣)为nm.MnO也属于NaCl型结构,晶胞参数为a'=0.448nm,则r(Mn2+)为nm.
四、[化学--选修5:有机化学基础]
-
12.
氟他胺G是一种可用于治疗肿瘤的药物.实验室由芳香烃A制备G的合成路线如下:
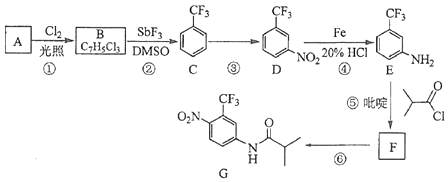
回答下列问题:
(1)、A的结构简式为 . C的化学名称是 .(2)、③的反应试剂和反应条件分别是 , 该反应的类型是 .(3)、⑤的反应方程式为 . 吡啶是一种有机碱,其作用是 .(4)、G的分子式为 .(5)、H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有种.(6)、4﹣甲氧基乙酰苯胺(
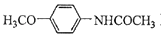 )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚( 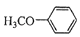 )制备4﹣甲氧基乙酰苯胺的合成路线(其他试剂任选).
)制备4﹣甲氧基乙酰苯胺的合成路线(其他试剂任选).
-