2017年高考理综真题试卷(化学部分)(新课标Ⅱ卷)
试卷更新日期:2017-06-12 类型:高考真卷
一、选本题共7个小题,每小题6分,共42分.在每小题给出的四个选项中,只有一项是符合题目要求的.
-
1. 下列说法错误的是( )A、糖类化合物也可称为碳水化合物 B、维生素D可促进人体对钙的吸收 C、蛋白质是仅由碳、氢、氧元素组成的物质 D、硒是人体必需的微量元素,但不宜摄入过多2. 阿伏加德罗常熟的值为NA . 下列说法正确的是( )A、1L0.1mol•L﹣1NH4CL溶液中,NH4+的数量为0.1NA B、2.4gMg与H2SO4完全反应,转移的电子数为0.1NA C、标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA D、0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA3. a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是( )A、原子半径:d>c>b>a B、4种元素中b的金属性最强 C、c的氧化物的水化物是强碱 D、d单质的氧化性比a单质的氧化性强4. 下列由实验得出的结论正确的是( )
实验
结论
A
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
生成的1,2﹣二溴乙烷无色、可溶于四氧化碳
B
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同的活性
C
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸的酸性
D
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生成的一氯甲烷具有酸性
A、A B、B C、C D、D5. 用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4﹣H2C2O4混合溶液.下列叙述错误的是( )A、待加工铝质工件为阳极 B、可选用不锈钢网作为阴极 C、阴极的电极反应式为:Al3++3e﹣═Al D、硫酸根离子在电解过程中向阳极移动6.改变0.1mol•L﹣1二元弱酸H2A溶液的pH,溶液中的H2A、HA﹣、A2﹣的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)= ].下列叙述错误的是( )
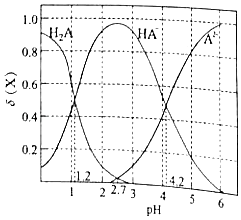 A、pH=1.2时,c(H2A)=c(HA﹣) B、pH=4.2时,lg[K2(H2A)]=﹣4.2 C、pH=2.7时,c(HA﹣)>c(H2A)=c(A2﹣) D、pH=4.2时,c(HA﹣)=c(A2﹣)=c(H2A)7. 由下列实验及现象不能推出相应结论的是( )
A、pH=1.2时,c(H2A)=c(HA﹣) B、pH=4.2时,lg[K2(H2A)]=﹣4.2 C、pH=2.7时,c(HA﹣)>c(H2A)=c(A2﹣) D、pH=4.2时,c(HA﹣)=c(A2﹣)=c(H2A)7. 由下列实验及现象不能推出相应结论的是( )实验
现象
结论
A.
向2 mL 0.1FeCl 3的溶液中加足量铁粉,震荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B.
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C.
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D.
向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一只试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)<Ksp(AgCl)
A、A B、B C、C D、D二、解答题(共3小题,满分43分)
-
8.
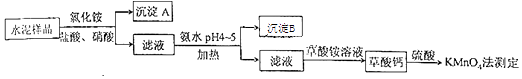
(14分)水泥是重要的建筑材料.水泥熟料的主要成分为CaO、SiO2 , 并含有一定量的铁、铝和镁等金属的氧化物.实验室测定水泥样品中钙含量的过程如图所示:
回答下列问题:
(1)、在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸.加入硝酸的目的是 , 还可使用代替硝酸.(2)、沉淀A的主要成分是 , 其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为 .(3)、加氨水过程中加热的目的是 . 沉淀B的主要成分为、(填化学式).(4)、草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4﹣+H++H2C2O4→Mn2++CO2+H2O.实验中称取0.400g水泥样品,滴定时消耗了0.0500mol•L﹣1的KMnO4溶液36.00mL,则该水泥样品中钙的质量分数为 .9. (14分)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备.回答下列问题:(1)、正丁烷(C4H10)脱氢制1﹣丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g)△H1
已知:②C4H10(g)+ O2(g)=C4H8(g)+H2O(g)△H2=﹣119kJ•mol﹣1
③H2(g)+ O2(g)=H2O(g)△H3 =﹣242kJ•mol﹣1
反应①的△H1为 kJ•mol﹣1 . 图(a)是反应①平衡转化率与反应温度及压强的关系图,x0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是(填标号).
A.升高温度B.降低温度C.增大压强D.降低压强
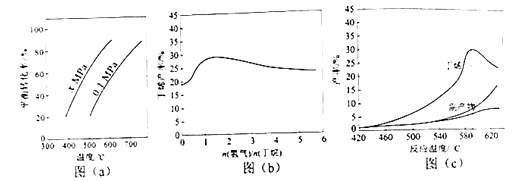 (2)、丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等.图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系.图中曲线呈现先升高后降低的变化趋势,其降低的原因是 .(3)、图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物.丁烯产率在590℃之前随温度升高而增大的原因可能是、;590℃之后,丁烯产率快速降低的主要原因可能是 .10. (15分)水中溶解氧是水生生物生存不可缺少的条件.某课外小组采用碘量法测定学校周边河水中的溶解氧.实验步骤及测定原理如下:
(2)、丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等.图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系.图中曲线呈现先升高后降低的变化趋势,其降低的原因是 .(3)、图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物.丁烯产率在590℃之前随温度升高而增大的原因可能是、;590℃之后,丁烯产率快速降低的主要原因可能是 .10. (15分)水中溶解氧是水生生物生存不可缺少的条件.某课外小组采用碘量法测定学校周边河水中的溶解氧.实验步骤及测定原理如下:Ⅰ.取样、氧的固定
用溶解氧瓶采集水样.记录大气压及水体温度.将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2 , 实现氧的固定.
Ⅱ.酸化,滴定
将固氧后的水样酸化,MnO(OH)2被I﹣还原为Mn2+ , 在暗处静置5min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O32﹣+I2=2I﹣+S4O62﹣).
回答下列问题:
(1)、取水样时应尽量避免扰动水体表面,这样操作的主要目的是 .(2)、“氧的固定”中发生反应的化学方程式为 .(3)、Na2S2O3溶液不稳定,使用前需标定.配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除及二氧化碳.(4)、取100.00mL水样经固氧、酸化后,用a mol•L﹣1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为mg•L﹣1 .(5)、上述滴定完成后,若滴定管尖嘴处留有气泡会导致测量结果偏 . (填“高”或“低”)三、[化学--选修3:物质结构与性质]
-
11. (15分)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表).回答下列问题:(1)、氮原子价层电子对的轨道表达式(电子排布图)为 .(2)、
元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1).第二周期部分元素的E1变化趋势如图(a)所示,
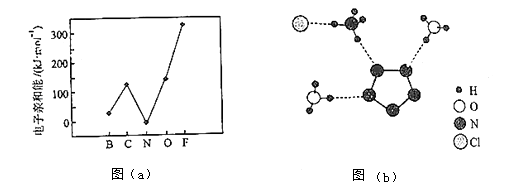
其中除氮元素外,其他元素的E1自左而右依次增大的原因是;氮元素的E1呈现异常的原因是 .
(3)、经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示.①从结构角度分析,R中两种阳离子的相同之处为 , 不同之处为 . (填标号)
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
②R中阴离子N5﹣中的σ键总数为个.分子中的大π键可用符号Πmn表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π66),则N5﹣中的大π键应表示为 .
③图(b)中虚线代表氢键,其表示式为(NH4+)N﹣H…Cl、、 .
(4)、R的晶体密度为dg•cm﹣3 , 其立方晶胞参数为anm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为 .四、[化学--选修5:有机化学基础]
-
12.
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6:1:1.
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应.
回答下列问题:
(1)、A的结构简式为 .(2)、B的化学名称为 .(3)、C与D反应生成E的化学方程式为 .(4)、由E生成F的反应类型为 .(5)、G是分子式为 .(6)、L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有种;其中核磁共振氢谱为四组峰,峰面积比为3:2:2:1的结构简式为、 .
-