2017年高考理综真题试卷(化学部分)(新课标Ⅰ卷)
试卷更新日期:2017-06-12 类型:高考真卷
一、选本题共7个小题,每小题6分.在每小题给出的四个选项中,只有一项是符合题目要求的.
-
1. 下列生活用品中主要由合成纤维制造的是( )A、尼龙绳 B、宣纸 C、羊绒衫 D、棉衬衣2. 《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之.”文中涉及的操作方法是( )A、蒸馏 B、升华 C、干馏 D、萃取3.
已知
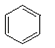 (b)、
(b)、  (d)、
(d)、 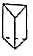 (p)的分子式均为C6H6 , 下列说法正确的是( )A、b的同分异构体只有d和p两种 B、b、d、p的二氯代物均只有三种 C、b、d、p均可与酸性高锰酸钾溶液反应 D、b、d、p中只有b的所有原子处于同一平面4.
(p)的分子式均为C6H6 , 下列说法正确的是( )A、b的同分异构体只有d和p两种 B、b、d、p的二氯代物均只有三种 C、b、d、p均可与酸性高锰酸钾溶液反应 D、b、d、p中只有b的所有原子处于同一平面4.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有碳等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )
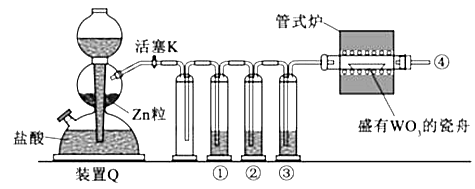 A、①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B、管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体浓度 C、结束反应时,先关闭活塞K,再停止加热 D、装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气5.
A、①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B、管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体浓度 C、结束反应时,先关闭活塞K,再停止加热 D、装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气5.支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极.下列有关表述不正确的是( )
 A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、高硅铸铁的作用是作为损耗阳极材料和传递电流 D、通入的保护电流应该根据环境条件变化进行调整6. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的.由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生.下列说法不正确的是( )A、X的简单氢化物的热稳定性比W强 B、Y的简单离子与X的具有相同的电子层结构 C、Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红 D、Z与X属于同一主族,与Y属于同一周期7.
A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、高硅铸铁的作用是作为损耗阳极材料和传递电流 D、通入的保护电流应该根据环境条件变化进行调整6. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的.由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生.下列说法不正确的是( )A、X的简单氢化物的热稳定性比W强 B、Y的简单离子与X的具有相同的电子层结构 C、Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红 D、Z与X属于同一主族,与Y属于同一周期7.常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
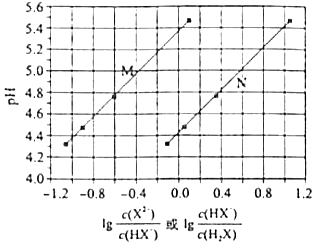 A、Ka2(H2X)的数量级为10﹣6 B、曲线N表示pH与lg 的变化关系 C、NaHX溶液中c(H+)>c(OH﹣) D、当混合溶液呈中性时,c(Na+)>c(HX﹣)>c(X2﹣)>c(OH﹣)=c(H+)
A、Ka2(H2X)的数量级为10﹣6 B、曲线N表示pH与lg 的变化关系 C、NaHX溶液中c(H+)>c(OH﹣) D、当混合溶液呈中性时,c(Na+)>c(HX﹣)>c(X2﹣)>c(OH﹣)=c(H+)二、解答题(共3小题)
-
8.
(15分)凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量.已知:NH3+H3BO3=NH3•H3BO3;NH3•H3BO3+HCl=NH4Cl+H3BO3 .
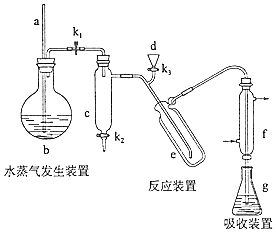
回答下列问题:
(1)、a的作用是 .(2)、b中放入少量碎瓷片的目的是 . f的名称是 .(3)、清洗仪器:g中加蒸馏水:打开K1 , 关闭K2、K3 , 加热b,蒸气充满管路:停止加热,关闭K1 , g中蒸馏水倒吸进入c,原因是;打开K2放掉水,重复操作2~3次.(4)、仪器清洗后,g中加入硼酸(H3BO3)和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭K1 , d中保留少量水,打开K1 , 加热b,使水蒸气进入e.①d中保留少量水的目的是 .
②e中主要反应的离子方程式为 , e采用中空双层玻璃瓶的作用是 .
(5)、取某甘氨酸(C2H3NO2)样品m 克进行测定,滴定g中吸收液时消耗浓度为cmol•L﹣1的盐酸V mL,则样品中氮的质量分数为%,样品的纯度≤%.9.(14分)Li4Ti3O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为Fe TiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
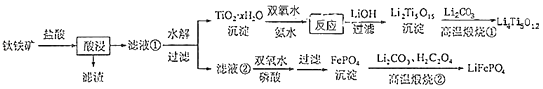
回答下列问题:
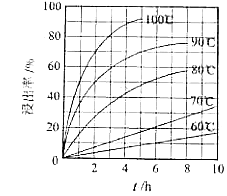
(1)、“酸浸”实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为 .
 (2)、“酸浸”后,钛主要以TiOCl42﹣形式存在,写出相应反应的离子方程式 .(3)、TiO2•xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
(2)、“酸浸”后,钛主要以TiOCl42﹣形式存在,写出相应反应的离子方程式 .(3)、TiO2•xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:温度/℃
30
35
40
45
50
TiO2•xH2O转化率/%
92
95
97
93
88
分析40℃时TiO2•xH2O转化率最高的原因 .
(4)、Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为 .(5)、若“滤液②”中c(Mg2+)=0.02mol•L﹣1 , 加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10﹣5 , 此时是否有Mg3(PO4)2沉淀生成?(列式计算).FePO4、Mg3(PO4)2的分别为1.3×10﹣22、1.0×10﹣24(6)、写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 .10. (14分)近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调解神经信号传递、舒张血管减轻高血压的功能.回答下列问题:(1)、下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是 (填标号).A、氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B、氢硫酸的导电能力低于相同浓度的亚硫酸 C、0.10mol•L﹣1的氢硫酸和亚硫酸的pH分别为4.5和2.1 D、氢硫酸的还原性强于亚硫酸(2)、下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为、 , 制得等量H2所需能量较少的是 .
(3)、H2S与CO2在高温下发反应:生H2S(g)+CO2(g)⇌COS(g)+H2O(g).在610k时,将0.10mol CO2与0.40mol H2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02.①H2S的平衡转化率a1=%,反应平衡常数K= .
②在620K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率a2a1 , 该反应的△H0.(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是(填标号)
A.H2S B.CO2 C.COS D.N2 .
三、[化学--选修3:物质结构与性质]
-
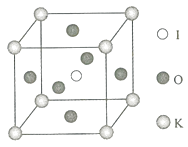
11. (15分)钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:(1)、元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为 nm(填标号).A、404.4 B、553.5 C、589.2 D、670.8 E、766.5(2)、基态K原子中,核外电子占据的最高能层的符号是 , 占据该能层电子的电子云轮廓图形状为 . K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是 .(3)、X射线衍射测定等发现,I3AsF6中存在I3+离子.I3+离子的几何构型为 , 中心原子的杂化类型为 .(4)、KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示.K与O间的最短距离为nm,与K紧邻的O个数为 .(5)、
在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于位置,O处于位置.
四、[化学--选修5:有机化学基础]
-
12.
化合物H是一种有机光电材料中间体.实验室由芳香化合物A制备H的一种合成路线如下:
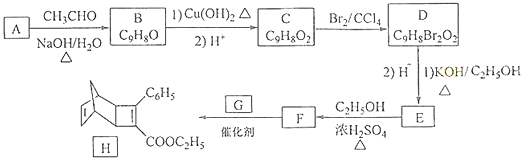
已知:①RCHO+CH3CHO RCH=CHCHO+H2O
②
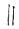 +
+ 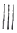

回答下列问题:
(1)、A的化学名称为为 .(2)、由C生成D和E生成F的反应类型分别为、 .(3)、E的结构简式为 .(4)、G为甲苯的同分异构体,由F生成H的化学方程式为 .(5)、芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2 , 其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,写出2种符合要求的X的结构简式 .(6)、写出用环戊烷和2﹣丁炔为原料制备化合物
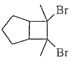 的合成路线(其他试剂任选).
的合成路线(其他试剂任选).
-