天津市南开区2018-2019学年中考化学一模考试试卷
试卷更新日期:2019-07-24 类型:中考模拟
一、单选题
-
1. 我们生活在不断变化的物质世界里,下列变化属于化学变化的是( )A、盐酸挥发 B、谷物酿酒 C、风力发电 D、滴水成冰2. 空气成分中,体积分数约占21%的是( )A、稀有气体 B、二氧化碳 C、氧气 D、氮气3. 下列图示实验操作中,正确的是( )A、
 B、
B、 C、
C、 D、
D、 4. 下列人体所必需的元素中,缺乏会引起贫血的是( )A、铁 B、钙 C、碘 D、锌5. 下列符号能表示2个氯原子的是( )A、Cl2 B、2Cl C、2Cl- D、2Cl26. 下列物质必须密封保存的是( )A、氯化钠 B、木炭 C、石灰石 D、浓硫酸7. 新型锂离子电池的主要成分是LiFePO4 , 已知锂(Li)的化合价为+1价,Fe的化合价为+2,则LiFePO4中P的化合价是( )A、+2 B、+3 C、+5 D、+68. 土壤的酸碱度会影响植物的生长。下列植物,在微碱性土壤中适宜种植的是( )
4. 下列人体所必需的元素中,缺乏会引起贫血的是( )A、铁 B、钙 C、碘 D、锌5. 下列符号能表示2个氯原子的是( )A、Cl2 B、2Cl C、2Cl- D、2Cl26. 下列物质必须密封保存的是( )A、氯化钠 B、木炭 C、石灰石 D、浓硫酸7. 新型锂离子电池的主要成分是LiFePO4 , 已知锂(Li)的化合价为+1价,Fe的化合价为+2,则LiFePO4中P的化合价是( )A、+2 B、+3 C、+5 D、+68. 土壤的酸碱度会影响植物的生长。下列植物,在微碱性土壤中适宜种植的是( )植物
胡萝卜
土豆
西红柿
南瓜
适宜的pH范围
5.0~6.0
4.8~5.4
6.0-7.0
6.0-8.0
A、胡萝卜 B、土豆 C、西红柿 D、南瓜9. 下列说法正确的是( )A、木炭燃烧生成黑色固体 B、红磷在空气中燃烧时,产生大量白色烟雾 C、硫燃烧后生成有刺激性气味的气体 D、氢气在空气中燃烧,发出蓝色火焰10. 烟道气中含有大量CO2 , CO2经“捕捉”后可用于生产甲醇(Z),反应的微观示意图如图:下列说法错误的是( ) A、一个Z分子中含有6个原子 B、参加反应的X与Y的质量比为22:1 C、反应中生成的Z与W的分子个数之比为1:1 D、参加反应的Y的质量等于生成的Z和W中氢元素的质量之和11. 过氧化钠(Na2O2)能与二氧化碳反应生成氧气,可作为呼吸面具中氧气的来源。潜水艇遇到紧急情况时,也使用过氧化钠来供氧,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。以下从该反应获取的信息中,正确的是( )
A、一个Z分子中含有6个原子 B、参加反应的X与Y的质量比为22:1 C、反应中生成的Z与W的分子个数之比为1:1 D、参加反应的Y的质量等于生成的Z和W中氢元素的质量之和11. 过氧化钠(Na2O2)能与二氧化碳反应生成氧气,可作为呼吸面具中氧气的来源。潜水艇遇到紧急情况时,也使用过氧化钠来供氧,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。以下从该反应获取的信息中,正确的是( )①过氧化钠属于氧化物 ②该反应属于置换反应 ③反应前后部分氧元素化合价发生了变化 ④实验室可利用这一原理制取纯净的氧气。
A、①③④ B、①③ C、①④ D、①②③12. 常温下,向一定量的碳酸钠溶液中不断加入氢氧化钡粉末,溶液质量的变化情况如图所示。对 该图的分析有如下几种说法正确的是( ) A、向 a 点溶液中滴加无色酚酞溶液,溶液变红,可证明有氢氧化钠生成 B、取少量 b 点溶液,滴入过量稀盐酸,有气泡产生 C、c 点溶液中的溶质只有氢氧化钠 D、该温度下,向 d 点溶液中加入氢氧化钡粉末,溶质质量不变
A、向 a 点溶液中滴加无色酚酞溶液,溶液变红,可证明有氢氧化钠生成 B、取少量 b 点溶液,滴入过量稀盐酸,有气泡产生 C、c 点溶液中的溶质只有氢氧化钠 D、该温度下,向 d 点溶液中加入氢氧化钡粉末,溶质质量不变二、多选题
-
13. 化学与生活密切相关,下列叙述中错误的是( )A、不慎打翻酒精灯而着火,用湿抹布扑灭主要是降低着火点 B、洗洁精具有乳化功能,可洗去餐盘上的油渍 C、铝制品比铁制品更耐腐蚀,因为铝表面易形成致密氧化膜 D、用点燃木条的方法检查液化石油气罐是否漏气14. 化学是一门以实验为基础的科学。下列实验中提供的方案不能达到目的是( )A、除去氧化钙中少量的碳酸钙,可加水溶解,过滤 B、不需要加入其他任何试剂就能鉴别出KOH、(NH4)2SO4、BaCl2、HCl四种溶液 C、探究氧气浓度对燃烧剧烈程度的影响,可将硫分别在空气和氧气中燃烧 D、除去CuCl2溶液中混有的少量FeCl2 , 可加入适量铁粉,过滤15. 有一包不纯的碳酸钾粉末,所含杂质可能是硝酸钾、硝酸钙、氯化钾、氯化亚铁、碳酸钠中的一种或几种。为确定其成分,进行如下实验:
①取少量该粉末于试管中,加足量的水充分溶解,得到无色澄清溶液。向该溶液中加入适量的硝酸银溶液,有白色沉淀产生,再加入足量的稀硝酸,充分反应后,部分白色沉淀消失。
②另取13.8g该粉末于烧杯中,加水使其完全溶解,再加入200g一定溶质质量分数的氯化钡溶液,恰好完全反应,过滤后得到19.7g白色沉淀和滤液a。
下列说法正确的( )
A、杂质中一定含有氯化钾,可能含有硝酸钾、碳酸钠 B、该包粉末的组成只有两种情况 C、滤液a中所含氯元素质量一定大于7.1g D、所用氯化钡溶液中溶质的质量分数为20.8%三、填空题
-
16. 化学就在我们身边。现有①碳酸氢钠 ②熟石灰 ③氧化钙 ④盐酸 ⑤活性炭 ⑥氮气,从中选择适当的物质按下列要求填空(填序号):(1)、可作某些食品干燥剂的是;(2)、焊接金属时常用作保护气的是;(3)、与硫酸铜溶液混合可配成波尔多液的是;(4)、能吸附有异味物质的是;(5)、焙制糕点所用的发酵粉的主要成分之一是;(6)、人体胃液中含有的酸是。17. 化学是在分子、原子层次上研究物质的科学。根据下图中提供的信息,请回答下列问题:
 (1)、由A图可知,硅原子的核外电子数为;(2)、B,C,D,E中属于同种元素的是(填字母序号),原因是它们的相同;(3)、B所示粒子在化学反应中容易电子(填“得到”或“失去”);其化学性质与 (填字母序号)相似;(4)、由C、E两种元素组成的化合物的化学式为。(5)、图2为元素周期表的部分,甲、乙代表两种不同元素,以下判断正确的是___________。
(1)、由A图可知,硅原子的核外电子数为;(2)、B,C,D,E中属于同种元素的是(填字母序号),原因是它们的相同;(3)、B所示粒子在化学反应中容易电子(填“得到”或“失去”);其化学性质与 (填字母序号)相似;(4)、由C、E两种元素组成的化合物的化学式为。(5)、图2为元素周期表的部分,甲、乙代表两种不同元素,以下判断正确的是___________。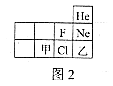 A、甲的原子序数大于乙 B、甲和Cl在同一周期 C、乙和He的最外层电子数相同18. 写出下列反应的化学方程式:(1)、碳在氧气中充分燃烧;(2)、锌和稀硫酸反应;(3)、碳酸氢钠和稀盐酸反应。19. 溶液在日常生活、工农业生产和科学研究中具有广泛的用途。(1)、可以作为溶质的是。
A、甲的原子序数大于乙 B、甲和Cl在同一周期 C、乙和He的最外层电子数相同18. 写出下列反应的化学方程式:(1)、碳在氧气中充分燃烧;(2)、锌和稀硫酸反应;(3)、碳酸氢钠和稀盐酸反应。19. 溶液在日常生活、工农业生产和科学研究中具有广泛的用途。(1)、可以作为溶质的是。A 只有固体 B 只有液体 C 只有气体 D 气体、液体、固体都可以
(2)、在盛有水的烧杯中加入以下某种物质,形成溶液后,温度下降。这种物质可能是___。A、氯化钠 B、硝酸铵 C、氢氧化钠 D、蔗糖(3)、下图为甲、乙、丙三种固体物质的溶解度曲线,请回答有关问题。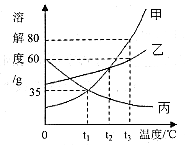
①将一瓶接近饱和的丙溶液变成饱和溶液,除通过增加溶质、蒸发溶剂使其达到饱和外,还可采取的方法。
②将t3℃时等质量的甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液的质量由大到的顺序为。
③t3℃时,取甲、乙两物质配制溶液。
序号
a
b
c
d
e
固体种类
甲
甲
甲
乙
乙
甲固体的质量/g
30
60
90
30
60
水的质量/g
100
100
100
100
100
(4)、I.关于a~e所得溶液属于饱和溶液的是。(5)、II.下列关于a~e所得溶液的说法错误的是_____。A、b溶液恒温蒸发25g水后,与c溶液溶质质量分数相等 B、e溶液的溶质质量分数为37.5% C、将a、d溶液降温至t1℃,均有晶体析出 D、c溶液恒温蒸发溶剂后,溶质质量分数变大四、简答题
-
20. 人们对水的组成的认识是科学家们在大量实验的基础上得出的。(1)、研究氢气的燃烧实验是人们认识水的组成开始。氢气在点燃前一定要。(2)、科学家们又用“电解法”证明了水的组成;下图中试管a、b中产生气体的体积比约为;检验b中产生的气体时看到的现象是。
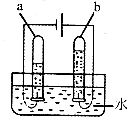 (3)、拉瓦锡还用另一实验证明了水的组成。
(3)、拉瓦锡还用另一实验证明了水的组成。他让水蒸气通过一根高温烧红的铁质枪管,结果得到了氢气,同时枪管表面有黑色固体(磁铁矿的主要成分)生成。该反应的化学方程式为;
(4)、自来水厂对天然水净化处理得到自来水的过程中,下列操作:①过滤;②吸附;③消毒;④蒸馏,其中没有用到的是(填序号)。(5)、生活中经常使用的方法降低水的硬度。21. 人类社会的发展离不开金属。请依据所学知识填空。(1)、考古工作者发现铁质的出土文物往往锈蚀严重,铁生锈的条件是铁与空气中的发生化学反应。在实验室常用稀盐酸清除铁锈,化学方程式为;(2)、某同学在实验室进行了两个有关金属性质的实验:实验I:硝酸银溶液和铁粉混合
实验II:硝酸铜溶液与铁粉混合
在上述两个实验结束后,该同学将实验I和II的物质全部倒入同一个烧杯中,发现烧杯内的红色固体明显增多。充分反应后过滤,向滤渣中滴加盐酸,没有气泡产生。则滤液中一定含有的溶质为(填化学式,下同),可能含有的溶质为。
(3)、与金属跟盐的反应相似,非金属也有这样的规律。Br2、I2、Cl2及其化合物有如下关系:Br2+2NaI=2NaBr+I2;Cl2+2NaI=2NaCl+I2;Cl2+2NaBr=2NaCl+Br2。由此可判断,非金属单质Br2、I2、Cl2的化学活动性由强到弱的顺序为。(4)、由硫酸铁和硫酸亚铁组成的混合物,经测定,其中硫元素的质量分数为a%,则混合物中铁元素的质量分数为。五、推断题
-
22. A,B,C,D,E,F都是初中化学中常见的化合物,其中A、B是盐,且B中含有钠元素;D是酸,C为白色沉淀。它们相互之间在溶液中可发生如下反应:
①C+D=A+2F ②2E+D=B+2F ③A+2E=C↓+B
根据上述信息回答问题:
(1)、写出物质的化学式:D , F;(2)、写出下列反应的化学方程式:反应①;
反应③。
六、实验题
-
23. 实验室利用下图实验装置进行有关实验。请根据装置回答下列问题:
 (1)、写出图中仪器a的名称:。(2)、实验室用高锰酸钾制取并收集氧气,应选用的装置为 (填字母,在A~E中选取),反应的化学方程式为;(3)、实验室用石灰石和稀盐酸制取二氧化碳,该反应的化学方程式为:;若得到纯净、干燥的二氧化碳气体(常混有少量氯化氢气体和水蒸气),可以按照“产生气体→F→F→真空气囊”的装置顺序连接,第一个F装置盛放试剂的作用 , 第二个F装置盛放的试剂为。
(1)、写出图中仪器a的名称:。(2)、实验室用高锰酸钾制取并收集氧气,应选用的装置为 (填字母,在A~E中选取),反应的化学方程式为;(3)、实验室用石灰石和稀盐酸制取二氧化碳,该反应的化学方程式为:;若得到纯净、干燥的二氧化碳气体(常混有少量氯化氢气体和水蒸气),可以按照“产生气体→F→F→真空气囊”的装置顺序连接,第一个F装置盛放试剂的作用 , 第二个F装置盛放的试剂为。七、流程题
-
24. 利用能源、节约能源、保护环境是我们大家共同关注的社会问题。某工厂将矿物燃料燃烧产生的废气中的SO2收集起来,既可以生产稀硫酸,又能制备氢气。其反应过程如下图所示:
 (1)、写出反应器中发生化学反应的方程式。(2)、此制备过程中可循环利用的物质是。(3)、硫酸用途广泛,汽车铅酸蓄电池中含有硫酸,其中需要用到溶质质量分数为24.5%的硫酸溶液。
(1)、写出反应器中发生化学反应的方程式。(2)、此制备过程中可循环利用的物质是。(3)、硫酸用途广泛,汽车铅酸蓄电池中含有硫酸,其中需要用到溶质质量分数为24.5%的硫酸溶液。①同学们在实验室用浓硫酸配制稀硫酸,除用到胶头滴管、量筒、烧杯外,还需要用到的仪器有。
②实验室用98%的浓硫酸(密度1.84g/mL)配制24.5%的硫酸溶液1200g,需要98%浓硫酸的体积为mL(计算结果保留至0.1)。
八、计算题
-
25. 磷酸二氢铵(NH4H2PO4)是一种化肥,它对提高农作物的产量具有重要作用。计算:(1)、NH4H2PO4的相对分子质量是;(2)、NH4H2PO4中氢、氧两种元素的质量比是 (填最简整数比);(3)、NH4H2PO4中氧元素的质量分数为(精确到0.1%)。26. 某硫酸铜样品中含有不溶性杂质(杂质不溶于水,不含铜元素,不与其他物质发生反应),兴趣小组同学欲测定硫酸铜的含量。进行了如下实验:①取样品20g加入81.8g足量的水搅拌充分溶解后,向其中加入56g氢氧化钾溶液,充分反应后过滤,得到8.9g不溶于水的物质和滤液a;②再向上述滤液a中继续加入56g氢氧化钾溶液,充分反应后过滤,又得到4.9g不溶于水的物质和只含一种溶质的滤液b。请计算:(1)、样品中硫酸铜的质量分数;(2)、最后所得滤液b中溶质的质量分数。
-
-
-