北京市西城区2018-2019学年中考化学二模考试试卷
试卷更新日期:2019-07-24 类型:中考模拟
一、单选题
-
1. 为防止佝偻病、骨质疏松,人体必需摄入的元素是( )A、钙 B、铁 C、锌 D、碘2. 下列物质属于氧化物的是( )A、O2 B、H2O C、Cu(OH)2 D、KClO33. 下列变化中,属于物理变化的是( )A、
 香蕉腐烂
B、
香蕉腐烂
B、 铁丝生锈
C、
铁丝生锈
C、 蜡烛燃烧
D、
蜡烛燃烧
D、 冰块融化
4. 某同学制作的试剂标签如下,其中化学式书写错误的是( )A、
冰块融化
4. 某同学制作的试剂标签如下,其中化学式书写错误的是( )A、 B、
B、 C、
C、 D、
D、 5. 下列做法,不利于节约用水的是( )A、用淘米水浇花 B、将雨水收集再利用 C、刷牙时始终打开水龙头 D、农业灌溉将漫灌改为滴灌6. 下列饮品属于溶液的是( )A、雪碧 B、牛奶 C、果粒橙 D、豆浆7. 下列关于物质用途的描述中,错误的是( )A、液氮用作制冷剂 B、大理石用于建筑材料 C、浓硫酸用作干燥剂 D、熟石灰用于治疗胃酸过多症8. 下列物质不需密封保存的是( )A、氯化钠 B、火碱 C、浓盐酸 D、生石灰9. 下列关于N2 + O2 2NO的说法中,正确的是( )A、反应后原子种类减少 B、表示氮气加氧气等于一氧化氮 C、参加反应的氮气与氧气的分子个数比为1∶1 D、参加反应的氧气与生成的一氧化氮的质量比为16∶1510. 木炭燃烧实验如下图。以下说法错误的是( )
5. 下列做法,不利于节约用水的是( )A、用淘米水浇花 B、将雨水收集再利用 C、刷牙时始终打开水龙头 D、农业灌溉将漫灌改为滴灌6. 下列饮品属于溶液的是( )A、雪碧 B、牛奶 C、果粒橙 D、豆浆7. 下列关于物质用途的描述中,错误的是( )A、液氮用作制冷剂 B、大理石用于建筑材料 C、浓硫酸用作干燥剂 D、熟石灰用于治疗胃酸过多症8. 下列物质不需密封保存的是( )A、氯化钠 B、火碱 C、浓盐酸 D、生石灰9. 下列关于N2 + O2 2NO的说法中,正确的是( )A、反应后原子种类减少 B、表示氮气加氧气等于一氧化氮 C、参加反应的氮气与氧气的分子个数比为1∶1 D、参加反应的氧气与生成的一氧化氮的质量比为16∶1510. 木炭燃烧实验如下图。以下说法错误的是( ) A、①中现象是木炭红热 B、②中操作是将木炭迅速插入底部 C、③可证明有二氧化碳生成 D、对比①②可证明氧气浓度越大,木炭燃烧越剧烈11. 4 ℃时,将一定质量的蔗糖放入100 g水中,充分溶解,烧杯底部有固体。升温至25 ℃,充分溶解后仍有少量固体。以下说法正确的是( )
A、①中现象是木炭红热 B、②中操作是将木炭迅速插入底部 C、③可证明有二氧化碳生成 D、对比①②可证明氧气浓度越大,木炭燃烧越剧烈11. 4 ℃时,将一定质量的蔗糖放入100 g水中,充分溶解,烧杯底部有固体。升温至25 ℃,充分溶解后仍有少量固体。以下说法正确的是( )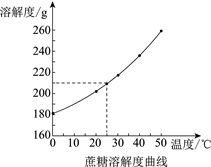 A、4 ℃时糖水中的微粒不再运动 B、4 ℃时加入蔗糖的质量可能为210 g C、25 ℃时充分溶解后,所得溶液中溶质和溶液质量比为210∶100 D、若使固体继续溶解,可采取升温或加水的方法12. 下列实验操作能达到实验目的的是( )
A、4 ℃时糖水中的微粒不再运动 B、4 ℃时加入蔗糖的质量可能为210 g C、25 ℃时充分溶解后,所得溶液中溶质和溶液质量比为210∶100 D、若使固体继续溶解,可采取升温或加水的方法12. 下列实验操作能达到实验目的的是( )选项
实验目的
实验操作
A
除去CO2中的CO
点燃
B
检验NaOH是否全部变质
取样,加入过量稀盐酸
C
证明CO2和H2O发生反应
将CO2通入水中
D
鉴别CO2、O2、空气
将燃着的木条分别伸入集气瓶中
A、A B、B C、C D、D二、填空题
-
13. 科学家用氮-15研究人类活动对全球氮循环的影响。氮-15是一种质子数为7、中子数为8的氮原子,其核外电子数为。
三、简答题
-
14. 下图为我国发行的人民币硬币,主要材料含有铁、铝、铜等。
 (1)、工业上用赤铁矿(主要成分Fe2O3)炼铁的化学方程式为。(2)、选择铸造硬币的材料,需要考虑的因素是_____(填序号)。A、金属的硬度 B、金属的导电性 C、金属的耐腐蚀性15. 工业上利用天然气“捕获”二氧化碳,以减少碳排放。该反应的微观示意图如下:
(1)、工业上用赤铁矿(主要成分Fe2O3)炼铁的化学方程式为。(2)、选择铸造硬币的材料,需要考虑的因素是_____(填序号)。A、金属的硬度 B、金属的导电性 C、金属的耐腐蚀性15. 工业上利用天然气“捕获”二氧化碳,以减少碳排放。该反应的微观示意图如下: (1)、在图中横线处补全相应微粒的图示。(2)、依据生活经验写出一条减少二氧化碳排放的措施。
(1)、在图中横线处补全相应微粒的图示。(2)、依据生活经验写出一条减少二氧化碳排放的措施。四、科普阅读题
-
16. 阅读下列科普短文。
新能源汽车已经走进了我们的生活。与传统汽车使用化石燃料不同,新能源汽车的能量来源更加多元化。
电动汽车
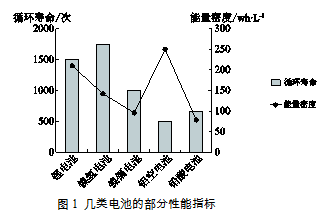
电池能为电动汽车提供动力,几类电池的部分性能指标如图1所示。其中能量密度表示单位体积的电池所具有的能量。
氢内燃车
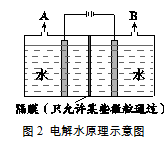
氢内燃车以氢气为燃料,不排放任何污染物。氢气可通过电解水(原理如图)等多种方式获得。据测算,1 kg氢气完全燃烧可释放14.3×104 kJ的热量,1 kg汽油完全燃烧可释放4.6×104 kJ的热量。
乙醇汽车
乙醇汽车以乙醇为燃料,乙醇是可再生能源,可以通过发酵甘蔗、玉米等农作物,或发酵粮食收割后剩余的秸秆大量提取。我国新能源汽车发展迅速,未来可期。
依据文章内容回答下列问题。
(1)、传统汽车采用化石燃料为能源。化石燃料包括煤、天然气和。(2)、依据图1,锂电池优于镍氢电池的性能指标是。(3)、1 kg氢气完全燃烧,消耗氧气的质量为kg。(4)、依据测算数据可知,氢内燃车与汽油车相比的优势是。(5)、下列说法正确的是_____(填序号)。A、依据图1可知,提供相同能量时,铝空电池的体积最小 B、图2中, A口产生的气体为氢气 C、农业大国盛产甘蔗和玉米,有利于推广乙醇汽车五、流程题
-
17. 亚氯酸钠(NaClO2)是常用的高效漂白剂,可用氯酸钠(NaClO3)制取,主要流程如下:
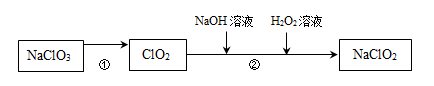 (1)、NaClO3中Cl元素的化合价为。(2)、②中,为防止H2O2分解过快,温度应控制在35 ℃以下。H2O2分解的化学方程式为。18. 硝酸锂(LiNO3)用于制造荧光体。其制备的主要流程如下:
(1)、NaClO3中Cl元素的化合价为。(2)、②中,为防止H2O2分解过快,温度应控制在35 ℃以下。H2O2分解的化学方程式为。18. 硝酸锂(LiNO3)用于制造荧光体。其制备的主要流程如下: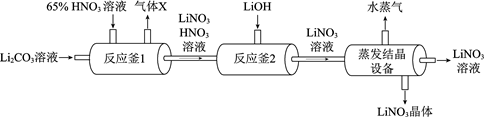 (1)、反应釜1中逸出的气体X是。(2)、反应釜2中发生的反应属于基本反应类型中的。(3)、蒸发结晶设备流出的LiNO3溶液是(填“饱和”或“不饱和”)溶液。
(1)、反应釜1中逸出的气体X是。(2)、反应釜2中发生的反应属于基本反应类型中的。(3)、蒸发结晶设备流出的LiNO3溶液是(填“饱和”或“不饱和”)溶液。六、实验题
-
19. 实验室用如图制取O2。
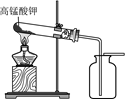 (1)、反应的化学方程式为。(2)、检验O2已收集满的操作是。20. 去除粗盐中难溶性杂质的主要操作如下图所示。
(1)、反应的化学方程式为。(2)、检验O2已收集满的操作是。20. 去除粗盐中难溶性杂质的主要操作如下图所示。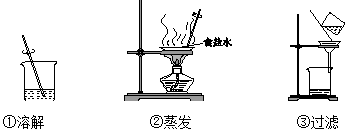 (1)、实验的正确操作顺序是(填序号,下同)。(2)、下列说法错误的是_____。A、溶解和过滤过程中,玻璃棒的作用相同 B、蒸发过程中,待溶液全部蒸干停止加热 C、过滤后得到的滤液为纯净物21. 用下图所示实验验证可燃物的燃烧条件。
(1)、实验的正确操作顺序是(填序号,下同)。(2)、下列说法错误的是_____。A、溶解和过滤过程中,玻璃棒的作用相同 B、蒸发过程中,待溶液全部蒸干停止加热 C、过滤后得到的滤液为纯净物21. 用下图所示实验验证可燃物的燃烧条件。已知:白磷的着火点为40 ℃, 红磷的着火点为240 ℃。
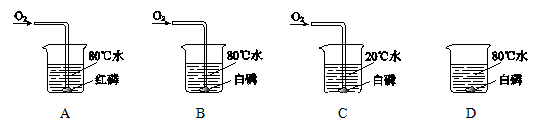 (1)、可观察到燃烧现象的实验是(填序号)。(2)、设计B、D的目的是。(3)、能验证可燃物燃烧温度需要达到着火点的现象是。22. 用下列实验研究酸与碱的反应。
(1)、可观察到燃烧现象的实验是(填序号)。(2)、设计B、D的目的是。(3)、能验证可燃物燃烧温度需要达到着火点的现象是。22. 用下列实验研究酸与碱的反应。 (1)、实验一中溶液由红色变为无色。用化学方程式解释该现象产生的原因:。(2)、实验二在滴加盐酸过程中,多次测量溶液的pH。证明反应发生的依据是。23. 如图所示,在白色点滴板1~3的孔穴中分别滴加2滴稀盐酸,4~6的孔穴中分别滴加2滴硫酸铜溶液。
(1)、实验一中溶液由红色变为无色。用化学方程式解释该现象产生的原因:。(2)、实验二在滴加盐酸过程中,多次测量溶液的pH。证明反应发生的依据是。23. 如图所示,在白色点滴板1~3的孔穴中分别滴加2滴稀盐酸,4~6的孔穴中分别滴加2滴硫酸铜溶液。 (1)、1、3孔穴中有气泡产生。孔穴1中反应的化学方程式为。(2)、金属表面有红色固体析出的孔穴是(填序号,下同)。(3)、比较Ni、Cu、Ag 3种金属的金属活动性顺序,可选择的孔穴有(写1组即可)。
(1)、1、3孔穴中有气泡产生。孔穴1中反应的化学方程式为。(2)、金属表面有红色固体析出的孔穴是(填序号,下同)。(3)、比较Ni、Cu、Ag 3种金属的金属活动性顺序,可选择的孔穴有(写1组即可)。七、科学探究题
-
24. 酱油在使用及储藏过程中颜色会变深,逐渐降低品质。实验小组通过实验研究温度、氧气、光照3个因素对酱油颜色的影响。
(查阅资料)① 通过色差仪检测L*值可监控酱油颜色变化,酱油颜色越深,L*值越小。
② 保鲜瓶具有的特点是挤出盛放的物质后,空气不会进入。
(实验准备)
将等量样品(同品牌、同批次、初始L*值为43.82的酱油)分装到500 mL的不同容器中,密封。
(进行实验)
实验1:将装有样品的多个透明玻璃瓶置于不同温度的恒温箱中。每15天,分别取出未开封样品,用色差仪检测L*值,结果如下。
编号
温度
15天
30天
45天
1-1
5 ℃
43.77
43.53
42.91
1-2
28 ℃
43.71
43.19
42.85
1-3
45 ℃
43.67
42.55
40.89
实验2:将装有样品的两个容器置于28 ℃的恒温箱中。每15天,分别倒出100 mL酱油,剩余样品放回恒温箱。用色差仪检测倒出样品的L*值,结果如下。
编号
容器
15天
30天
45天
2-1
透明玻璃瓶
43.45
42.36
41.30
2-2
透明保鲜瓶
43.72
42.98
42.53
实验3:将装有样品的多个容器置于28 ℃的恒温箱中。每15天,分别取出未开封样品,用色差仪检测L*值,结果如下。

(解释与结论)
(1)、实验1得出的结论是。(2)、实验2的目的是。(3)、实验3欲研究光照对酱油颜色的影响,应选用的容器是。(4)、家庭常使用透明玻璃瓶盛放酱油。解释“在相同时间内,使用过的酱油比未开封的酱油颜色深”可依据的实验是(填编号)。(5)、(反思与评价)结合本实验,你对使用或储藏酱油的建议是。
(6)、酱油在酿造过程中,有时会产生过量的铵盐(如NH4Cl)影响酱油的口感。可用碳酸钠除去铵盐,原理如下,补全该反应的化学方程式。Na2CO3 + 2NH4Cl = 2NaCl + 2NH3↑ + H2O +
-
-