北京市门头沟区2018-2019学年中考化学二模考试试卷
试卷更新日期:2019-07-24 类型:中考模拟
一、单选题
-
1. 空气成分中,体积分数最大的是( )A、氮气 B、氧气 C、二氧化碳 D、稀有气体2. 下列制作蛋糕的原料中,富含蛋白质的是()A、面粉 B、白糖 C、鸡蛋 D、橄榄油3. 下列符号中,表示2个氢原子的是()A、H2 B、2H C、2H+ D、2H24. 下列实验操作中,正确的是( )A、倾倒液体
 B、称量氢氧化钠
B、称量氢氧化钠  C、测定溶液的pH
C、测定溶液的pH  D、稀释浓硫酸
D、稀释浓硫酸  5. 下列关于电解水实验的说法中,正确的是( )
5. 下列关于电解水实验的说法中,正确的是( ) A、管a中的气体为H2 B、与管a相连的是电源的正极 C、管a与管b中气体质量比为2:1 D、该实验可说明水由H2和O2组成6. 下列物质露置于空气中,质量会减小的是( )A、浓硫酸 B、浓盐酸 C、氢氧化钠 D、氯化钠7. 下列方法能区分氧气和二氧化碳两瓶气体的是( )
A、管a中的气体为H2 B、与管a相连的是电源的正极 C、管a与管b中气体质量比为2:1 D、该实验可说明水由H2和O2组成6. 下列物质露置于空气中,质量会减小的是( )A、浓硫酸 B、浓盐酸 C、氢氧化钠 D、氯化钠7. 下列方法能区分氧气和二氧化碳两瓶气体的是( )
A、闻气味 B、观察颜色 C、倒入适量氢氧化钠溶液 D、将燃着的木条伸入集气瓶中8. 小刚测定了下列4种日用品的pH,其中呈酸性的是( )日用品
A.洁厕灵
B.洗涤灵
C.洗发水
D.消毒液
pH
1
7
9
12
A、A B、B C、C D、D9. 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号。下列有关该实验的说法中,正确的是( ) A、红磷燃烧的化学方程式为P+O2 P2O5 B、红磷熄灭后,立刻打开弹簧夹 C、最终瓶中剩余的气体是纯净的氮气 D、瓶中液面最终上升至1处,证明空气中O2含量约为1/5体积10. A和B点燃条件下反应生成C和D。反应前后分子变化的微观示意图如下:
A、红磷燃烧的化学方程式为P+O2 P2O5 B、红磷熄灭后,立刻打开弹簧夹 C、最终瓶中剩余的气体是纯净的氮气 D、瓶中液面最终上升至1处,证明空气中O2含量约为1/5体积10. A和B点燃条件下反应生成C和D。反应前后分子变化的微观示意图如下: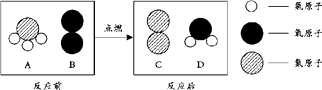
下列说法错误的是( )
A、一个A分子中含有4个原子 B、D的化学式为H2O C、生成物C和D的质量比为14:9 D、4种物质中,属于化合物的是A和D二、选择题组
-
11. 依据下列溶解度曲线和实验过程回答下列小题
 (1)、①~④所得溶液属于饱和溶液的是( )A、①③ B、②④ C、②③ D、③④(2)、下列关于①~④所得溶液的说法错误的是( )A、溶质质量:③<④ B、溶液质量最大的是③ C、溶质质量分数:②=④ D、④中溶质与溶剂的质量比为1:5
(1)、①~④所得溶液属于饱和溶液的是( )A、①③ B、②④ C、②③ D、③④(2)、下列关于①~④所得溶液的说法错误的是( )A、溶质质量:③<④ B、溶液质量最大的是③ C、溶质质量分数:②=④ D、④中溶质与溶剂的质量比为1:5三、填空题
-
12. 补齐连线。从13-A或13-B中任选一个作答,若均作答,按13-A计分。
13-A 物质——用途
13-B 名称——俗称
a天然气 ①调味品
b熟石灰 ②气体燃料
c食盐 ③改良酸性土壤
a氢氧化钠 ①小苏打
b碳酸钠 ②烧碱
c碳酸氢钠 ③纯碱
A.a b
B.a b
13. 2022年第24届冬季奥林匹克运动会将在我国北京-张家口举办。(1)、下列冬奥会事项与化学无关的是_____________A、研制新型材料用于场馆建设 B、在短道速滑的冰道上洒水减少摩擦 C、用消毒剂处理奥运村生活污水 D、用清洁能源做汽车燃料接送运动员(2)、造雪机的工作原理如图所示。A处空气被压缩,体积变小。从微粒的角度解释其原因是__。 14. 首钢曾经的炼铁设备改造成冬奥滑雪大跳台,实现工业遗迹与体育文化的完美结合。(1)、首钢用赤铁矿(主要成分为Fe2O3)和CO炼铁的化学方程式为。(2)、以水为原料进行人工造雪,该过程属于(填“物理”或“化学”)变化。15. 半水煤气的主要成分是H2、CO、CO2、N2和水蒸气。工业上用半水煤气合成氨(NH3)的过程如下所示。
14. 首钢曾经的炼铁设备改造成冬奥滑雪大跳台,实现工业遗迹与体育文化的完美结合。(1)、首钢用赤铁矿(主要成分为Fe2O3)和CO炼铁的化学方程式为。(2)、以水为原料进行人工造雪,该过程属于(填“物理”或“化学”)变化。15. 半水煤气的主要成分是H2、CO、CO2、N2和水蒸气。工业上用半水煤气合成氨(NH3)的过程如下所示。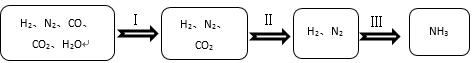 (1)、过程Ⅰ中,发生反应的化学方程式为CO + H2O H2+ , 请补全该反应。(2)、过程Ⅲ合成氨(NH3)的过程中,氮元素化合价发生的变化是。
(1)、过程Ⅰ中,发生反应的化学方程式为CO + H2O H2+ , 请补全该反应。(2)、过程Ⅲ合成氨(NH3)的过程中,氮元素化合价发生的变化是。四、科普阅读题
-
16. 阅读下面科普短文。
与“张牙舞爪”的雾霾相比,臭氧污染“隐藏”在万里晴空中,已成为夏季众多城市的大气环境污染元凶。
2019年3月29日,中国环境科学学会臭氧污染控制专业委员会成立。该领域的众多知名专家学者共同探讨大气臭氧污染防控的方向和路径。
臭氧(O3)原本是大气中自然产生的一种具有特殊臭味的微量气体,绝大部分臭氧存在于离地面25公里左右处的大气平流层中,这就是人们通常所说的臭氧层,它吸收对人体有害的短波紫外线,防止其到达地球。可它为何又是危害环境的污染物?
地表空气中的臭氧对人体极为有害,一些易于过敏的人长时间暴露在臭氧含量超过180微克/立方米的环境中,会产生眼睛刺痛,咳嗽等不良症状。研究表明,空气中每立方米臭氧含量增加100微克,人的呼吸功能就会减弱3%,对于运动员来说,空气中的臭氧含量可以直接影响到他们的耐力和比赛成绩。地表臭氧并不是人类活动直接排放出的污染物,而是因为氮氧化物或挥发性有机物与氧气结合而形成的,强烈的阳光照射会加速这一化学反应。氮氧化物主要来自于燃煤、汽车尾气等;挥发性有机污染物来源相对非常复杂,涂料、燃油、炼油厂、干洗店等,都会产生这种污染物。自2013年中国执行新《环境空气质量标准》,监测6种污染物以来,臭氧便成为一些城市夏季空气质量“超标日”的首要污染物,右图为某地臭氧、NO、NO2、NOX昼间12小时均值变化规律。
我国对于臭氧污染控制尚处于起步阶段,有效降低臭氧浓度依然任重而道远。
依据文章内容回答下列问题:
(1)、从微观角度解释,氧气和臭氧化学性质不同的原因不同。(2)、地表空气中的臭氧是由生成的。(3)、如图,某地夏季某日昼时,臭氧污染最严重的时间段是(填序号)。
A 8:00~10:00 B 10:00~12:00 C 12:00~14:00 D 14:00~16:00
(4)、下列说法正确的是(填序号)。A 臭氧是一种无色无味气体
B 臭氧层具有吸收紫外线的作用
C 地表空气中臭氧的含量与天气阴晴无关
D 空气中臭氧浓度不同会对人体造成不同程度的影响
(5)、为了减少臭氧污染,请你向市民提出一条可行建议 .五、流程题
-
17. “碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。其过程的示意图如下。
 (1)、除H2O外,上图中涉及的氧化物还有。(2)、捕捉室中发生反应的化学方程式为。(3)、高温煅烧室中发生的反应为CaCO3 CaO + CO2↑;若通过该反应释放22tCO2 , 需要CaCO3的质量为t。
(1)、除H2O外,上图中涉及的氧化物还有。(2)、捕捉室中发生反应的化学方程式为。(3)、高温煅烧室中发生的反应为CaCO3 CaO + CO2↑;若通过该反应释放22tCO2 , 需要CaCO3的质量为t。六、实验题
-
18. “去除粗盐中难溶性杂质”的实验操作如下图所示。
 (1)、此实验的正确操作顺序是(填序号,下同)。(2)、操作②中,玻璃棒的作用是。
(1)、此实验的正确操作顺序是(填序号,下同)。(2)、操作②中,玻璃棒的作用是。A 引流 B 加快溶解 C 防止局部温度过高,液滴飞溅
19. 如图是“铁丝在氧气中燃烧”的实验改进装置 (1)、该实验中制取氧气反应的化学方程式为。(2)、铁丝遇O2燃烧时,现象为。20. 利用下图所示装置进行实验(装置气密性良好)。
(1)、该实验中制取氧气反应的化学方程式为。(2)、铁丝遇O2燃烧时,现象为。20. 利用下图所示装置进行实验(装置气密性良好)。 (1)、打开K1、K2 , 注入一定量的稀盐酸后,关闭K2。B中反应的化学方程式为。A装置的作用是。(2)、打开K3、关闭K1 , 用C装置收集气体,验满的方法是。21. 用下图所示实验验证可燃物燃烧的条件。
(1)、打开K1、K2 , 注入一定量的稀盐酸后,关闭K2。B中反应的化学方程式为。A装置的作用是。(2)、打开K3、关闭K1 , 用C装置收集气体,验满的方法是。21. 用下图所示实验验证可燃物燃烧的条件。已知:红磷的着火点为240℃。
 (1)、设计A,C的目的是。(2)、能验证可燃物需要O2的现象是。22. 根据如图所示实验,探究酸碱中和反应。
(1)、设计A,C的目的是。(2)、能验证可燃物需要O2的现象是。22. 根据如图所示实验,探究酸碱中和反应。 (1)、实验一:通过溶液酸碱性变化证明酸碱发生中和反应。
(1)、实验一:通过溶液酸碱性变化证明酸碱发生中和反应。图①中证明碱与酸发生反应的现象是。
(2)、图②中b、c、d三点处对应溶液所含溶质 NaCl的质量大小关系。(3)、实验二:通过证明酸碱发生中和反应。
七、科学探究题
-
23. 小明同学在练习“金属的化学性质”实验操作时,发现几支试管中冒出气泡有快有慢,于是他与小芳同学一起合作进行如下探究。
(提出问题)金属与酸反应的快慢受哪些因素影响呢?
(猜想与假设)A.可能与酸的浓度有关;B.可能与金属的种类有关;C.可能与金属的形状有关。
(设计并实验)小明和小芳进行如下实验。
实验编号
盐酸的浓度(均取20mL)
金属(均取2g)
金属的形状
收集50mL氢气所需时间/s
①
10%
镁
粉状
60
②
10%
铁
片状
120
③
10%
镁
片状
102
④
20%
铁
片状
110
(1)、实验时需将镁片和铁片进行打磨,其目的是。(2)、写出铁与稀盐酸反应的化学方程式:。(3)、要比较不同种类的金属对反应快慢的影响,应选择的实验编号是。(4)、(得出结论)通过上述四个实验,你得出的影响金属与酸反应的因素有。(5)、实验①中试管外壁发烫,说明镁与稀盐酸反应是放热反应。实验测得该反应中产生气体的速率(v)与时间(t)的关系如图所示,你认为在t2 ~t3时间段内反应速率逐渐减慢的主要原因是。 (6)、(实验反思)本实验采用的定量比较气体产生速率的方法是。
(6)、(实验反思)本实验采用的定量比较气体产生速率的方法是。
-
-
-