四川省泸州市2019年中考化学试卷
试卷更新日期:2019-07-22 类型:中考真卷
一、单选题
-
1. 下列物质不溶于水的是()A、酒精 B、硝酸 C、蔗糖 D、铁锈2. 下列物质不能与盐酸反应的是()A、Mg B、AgNO3 C、Cu(OH)2 D、FeSO43. 下列说法错误的是()A、H2O2属于氧化物 B、碳元素与氧元素位于同一周期 C、NaNO2中氮元素的化合价为+5价 D、1个钠原子失去1个电子变成钠离子4. 下列叙述错误的是()A、氢氧燃料电池是将电能转换成热能的装置 B、人体必需元素长期摄入不足不利于健康 C、食品在霉变过程中发生了化学变化 D、油脂可在小肠中转化为脂肪酸和甘油5. 某品牌牛奶的营养成分如表所示,对1盒250mL的牛奶,叙述正确的是()
 A、碳水化合物提供的能量为288kJ B、维生素D有助于骨骼和牙齿的生长发育 C、含Ca单质的质量为128mg D、蛋白质在人体内仅转化为N2排出体外6. 下列装置有误或不能完成对应实验的是()A、用于过滤粗盐水中的泥沙杂质
A、碳水化合物提供的能量为288kJ B、维生素D有助于骨骼和牙齿的生长发育 C、含Ca单质的质量为128mg D、蛋白质在人体内仅转化为N2排出体外6. 下列装置有误或不能完成对应实验的是()A、用于过滤粗盐水中的泥沙杂质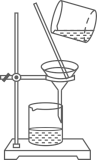 B、用于食盐水的蒸发结晶
B、用于食盐水的蒸发结晶  C、用于实验室即关即停制取H2
C、用于实验室即关即停制取H2  D、用于除去H2中的HCl杂质
D、用于除去H2中的HCl杂质  7. 下列反应的化学方程式及其应用都正确的是()A、Fe3O4+4CO 3Fe+4CO2 , 工业上用于冶炼铁 B、BaCl2+H2O+CO2═BaCO3↓+2HCl,用于制取透视检查胃肠的钡餐 C、Al3O2=3Al+O2↑,工业上用于冶炼铝 D、NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl↓,用于制取复合肥料8. 以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是()
7. 下列反应的化学方程式及其应用都正确的是()A、Fe3O4+4CO 3Fe+4CO2 , 工业上用于冶炼铁 B、BaCl2+H2O+CO2═BaCO3↓+2HCl,用于制取透视检查胃肠的钡餐 C、Al3O2=3Al+O2↑,工业上用于冶炼铝 D、NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl↓,用于制取复合肥料8. 以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是()0℃
10℃
20℃
30℃
40℃
50℃
60℃
Na2CO3的溶解度(g/100g水)
7.1
12.5
21.5
39.7
49.0
48.5
46.0
NaHCO3的溶解度(g/100g水)
6.9
8.1
9.6
11.1
12.7
14.5
16.4
A、40℃的饱和Na2CO3溶液升温到60℃,会析出晶体 B、60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体 C、30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出 D、20℃的饱和Na2CO3溶液中通足量CO2 , 生成的NaHCO3会部分析出二、填空题
-
9. 如图为世界最长的跨海大桥--港珠澳大桥,于2018年10月24日正式通车,凸显了我国领先的造桥技术。回答下列问题:
 (1)、建造大桥使用了大量钢材、水泥、玻璃、橡胶等材料,其中属于有机物的是 , 能导电的是。(2)、造桥用的钢管浸泡在海水中易发生腐蚀,造成钢管腐蚀的物质包括水、二氧化碳、。10. 我国科学家屠呦呦因成功提取了青蒿素而获得2015年诺贝尔生理学或医学奖。青蒿素的使用在全世界“拯救了几百万人的生命”。青蒿用乙醚浸泡可提取其有效成分青蒿素,再利用乙醚沸点低易分离的特点,回收循环利用乙醚。回答下列问题:
(1)、建造大桥使用了大量钢材、水泥、玻璃、橡胶等材料,其中属于有机物的是 , 能导电的是。(2)、造桥用的钢管浸泡在海水中易发生腐蚀,造成钢管腐蚀的物质包括水、二氧化碳、。10. 我国科学家屠呦呦因成功提取了青蒿素而获得2015年诺贝尔生理学或医学奖。青蒿素的使用在全世界“拯救了几百万人的生命”。青蒿用乙醚浸泡可提取其有效成分青蒿素,再利用乙醚沸点低易分离的特点,回收循环利用乙醚。回答下列问题:
(1)、提取青蒿素的过程是变化(填“物理”或“化学”)。(2)、青蒿素的分子式为C15H22O5 , 则1个青蒿素分子中含有个原子,其中碳元素与氧元素的质量比为。三、简答题
-
11. 1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了如下实验。他们用一束质量远大于电子的高速运动的α粒子轰击金箔,发现:“大多数α粒子能穿过金箔,一小部分发生偏转,极少数被反弹回来。”回答下列问题:
甲
 乙
乙  (1)、1个α粒子由2个中子和2个质子构成,则α粒子带电(填“正”或“负”),1个α粒子与1个He-4原子构成上的差别是。(2)、甲图为金的原子结构示意图,乙图摘自元素周期表,据此推断a= , b=。(3)、根据实验现象中α粒子“大多数”与“极少数”的对比分析,你能想象出关于Au原子结构的结论是。12. 水污染与防治是当今人类需要关注的环境问题之一,工农业废水和生活污水是水污染的主要来源。回答下列问题:(1)、酸雨(填“能”或“不能”)污染水体,煤燃烧产生SO2 , SO2形成酸雨的主要原因是。(2)、废旧电池中含有的汞、镉等重金属会污染水体,造成生物体中毒,其原因是重金属能使生物体内的(填化学物质)结构破坏,失去生理活性。(3)、某工业废水含HgSO4 , 可通过铁网而将汞留下,加热将汞形成蒸气回收利用。其反应的化学方程式为 , 汞的沸点(填“低于”或“高于”)铁的沸点。也可以向废水中加入Na2S溶液形成沉淀而除去汞,该沉淀的化学式为。(4)、甲厂污水含硫酸的质量分数为0.98%,其流速为45kg/s,乙厂污水含烧碱的质量分数为0.4%,为排放达标,现将两厂的污水混合处理,反应的化学方程式为 , 则乙厂污水的最佳流速为kg/s。
(1)、1个α粒子由2个中子和2个质子构成,则α粒子带电(填“正”或“负”),1个α粒子与1个He-4原子构成上的差别是。(2)、甲图为金的原子结构示意图,乙图摘自元素周期表,据此推断a= , b=。(3)、根据实验现象中α粒子“大多数”与“极少数”的对比分析,你能想象出关于Au原子结构的结论是。12. 水污染与防治是当今人类需要关注的环境问题之一,工农业废水和生活污水是水污染的主要来源。回答下列问题:(1)、酸雨(填“能”或“不能”)污染水体,煤燃烧产生SO2 , SO2形成酸雨的主要原因是。(2)、废旧电池中含有的汞、镉等重金属会污染水体,造成生物体中毒,其原因是重金属能使生物体内的(填化学物质)结构破坏,失去生理活性。(3)、某工业废水含HgSO4 , 可通过铁网而将汞留下,加热将汞形成蒸气回收利用。其反应的化学方程式为 , 汞的沸点(填“低于”或“高于”)铁的沸点。也可以向废水中加入Na2S溶液形成沉淀而除去汞,该沉淀的化学式为。(4)、甲厂污水含硫酸的质量分数为0.98%,其流速为45kg/s,乙厂污水含烧碱的质量分数为0.4%,为排放达标,现将两厂的污水混合处理,反应的化学方程式为 , 则乙厂污水的最佳流速为kg/s。四、科学探究题
-
13. 已知:Na2O为白色,Na2O2为淡黄色;Na2O+H2O=2NaOH.某兴趣小组对钠和铜的单质及其化合物的性质进行了如下实验探究。
①将铜片置于铁架台的铁圈上,用酒精灯加热,观察到铜片表面变黑;
②趁热将钠置于铜片表面,钠剧烈燃烧,有淡黄色物质生成,将此淡黄色物质转移到试管中待用,再用蒸馏水冲洗铜片,观察到铜片上钠燃烧处出现了光亮的铜斑;
③向盛装淡黄色物质的试管中滴加蒸馏水,观察到冒气泡,将带火星的木条伸入试管,木条复燃。
回答下列问题:
(1)、步骤①产生的黑色物质是 , 步骤②淡黄色产物中氧元素的化合价为价。(2)、步骤②中产生铜斑反应的另一产物,进一步与氧气反应也转化为淡黄色物质,则产生铜斑反应的化学方程式为。(3)、步骤③产生的气体物质为。(4)、猜想步骤③还可能有一种常见物质(填化学式)生成,向反应后的溶液中滴加溶液(可供选择的试剂:H2SO4、CuSO4、KOH、Na2CO3),观察到的现象时,即证明了你的猜想。五、实验题
-
14. 已知:相同条件下,氨气的密度比空气小,极易溶于水,其水溶液称为氨水,溶质NH3•H2O能解离出NH4+和OH- . 某同学对其制备与性质进行了如下探究。回答下列问题:(1)、氨气制取:固体NH4Cl与足量消石灰混合加热可以制取氨气。
①选择的发生装置是 , 收集装置是(选填大写字母)。
②结合选择的装置完成氨气的制取、收集并吸收氨气制取氨水,按气流顺序各装置的接口从左到右依次为(用小写字母表示)。

③充分反应后冷却,将残余固体转移到烧杯中,加水溶解,还需要的玻璃仪器是 , 溶液中的阳离子为。
(2)、性质探究:向滴加了酚酞试液的氨水中再滴加足量AlCl3溶液,观察到的现象是 , 反应的化学方程式为。六、流程题
-
15. 水与自然界中矿石长期接触,常含Ca(HCO3)2、Mg(HCO3)2等物质,导致钙离子、镁离子含量较多,称之为硬水。生活中,水的硬度过高会造成一定危害。长期使用硬水烧水的热水壶,内部会形成一层水垢,其主要成分为碳酸钙和氢氧化镁,说明加热煮沸可使这类硬水成为软水。其原理的流程如下、题(气体产物已略去):

回答下列问题:
(1)、反应Ⅰ属于四大基本反应类型中的反应;反应Ⅱ除产生水垢外,还有一种气体产物为;如果当地硬水中CaSO4含量较多,则水垢中还常含有少量CaSO4 , CaSO4析出的原因是。(2)、向200g水垢中加入400g过量的稀盐酸,充分反应,测得3分钟内混合物质量的变化(不考虑水与HCl的挥发)如下表所示:时间/s(秒)
0
30
60
90
120
180
混合物的质量/g
600
574
554
547.2
547.2
547.2
①观察到的现象是
②计算水垢中碳酸钙的质量分数 , 写出必要的计算过程。
-
-