贵州省黔西南州2019年中考化学试卷
试卷更新日期:2019-07-22 类型:中考真卷
一、单选题
-
1. 中国古诗词既蕴含人文思想,又闪耀理性光辉。对下列古诗词划线部分隐含的化学现象解释不合理的是( )A、千锤万凿出深山,烈火焚烧若等闲——煅烧石灰石,不发生化学变化 B、花气袭人知骤暖 , 鹊声穿树喜新晴——温度升高,分子运动加快 C、何意百炼钢 , 化为绕指柔——生铁经不断煅烧捶打氧化,降低碳的含量后变成钢 D、美人首饰侯王印,尽是沙中浪底来——金的化学性质稳定,在自然界中以单质形态存在2. 下列实验操作错误的是()A、
 除去O2中的CO2
B、
除去O2中的CO2
B、 稀释浓硫酸
C、
稀释浓硫酸
C、 点燃酒精灯
D、
点燃酒精灯
D、 检查装置的气密性
3. 化学反应前后肯定没有发生变化的是()
检查装置的气密性
3. 化学反应前后肯定没有发生变化的是()①原子数目;②分子数目;③元素种类;④物质种类;⑤原子种类;⑥物质的总质量。
A、①④⑥ B、①③⑤⑥ C、①②⑥ D、②③⑤4. H1N1 流感疫情曾在我国大面积爆发。实践表明,出现这种疫情时可用过氧乙酸(C2H4O3) 消毒杀菌。下列有关过氧乙酸的叙述错误的是( )A、由碳、氢、氧三种元素组成 B、其分子中含有臭氧(O3) C、既是纯净物,也是化合物 D、碳、氢、氧元素的质量比为 6:l:125. 下列各实验方案能达到其实验目的的是( )选项
实验目的
实验方案
A
鉴别氢氧化钠溶液和稀盐酸
分别取样滴加紫色石蕊溶液
B
除去NaOH 溶液中混有的Na2CO3
加入足量稀盐酸
C
除去 CO2 中混有的少量 CO
在足量的氧气中点燃
D
鉴别氮气和二氧化碳
将燃着的木条分别伸入气体中
A、A B、B C、C D、D6. 下列各组离子在溶液中能大量共存的是( )A、Na+、H+、Cl-、OH- B、Ag+、K+、Cl-、NO– C、Na+、H+、NO3– 、CO32- D、H+、Mg2+、SO42– 、Cl-二、填空题
-
7. 用化学用语填空:(1)、3个二氧化硫分子:。(2)、保持氩气化学性质的最小粒子。(3)、空气中含量最多的气体:。(4)、氧化铁中铁元素的化合价:。(5)、13号元素原子的结构示意图:。8. 化学与人类生活、生产活动息息相关。根据所学化学知识回答下列问题:(1)、生活中常用来区分硬水和软水。(2)、人的胃液里含有适量的(填名称),可以帮助消化。(3)、食用“加铁酱油”可预防贫血,其中的“铁”是指(填“元素”或“原子”)。(4)、厨房油锅着火,盖上锅盖可以立即灭火,其原理是。(5)、将少量某塑料样品在密闭容器中与足量的O2反应,生成了CO2和H2O,由此可知该塑料中一定含有元素。(6)、稀土有“工业的维生素”的美誉。稀土元素Tm在元素周期表中的信息如图,下列有关Tm的判断错误的是(填序号)。

①原子的质子数为69
②属于金属元素
③原子的中子数为69
④相对原子质量为168.9
9. 如图所示为①KNO3②NaCl③H3BO3的溶解度曲线,由图可知: (1)、当温度为10℃时,KNO3、NaCl和H3BO3三种物质的溶解度由大到小的顺序为(用序号作答)。(2)、当温度为t℃时,在三种物质的饱和溶液中溶质的质量分数由大到小的顺序为(用序号作答)。(3)、要将P点处的KNO3溶液变成饱和溶液,可采取的措施有:加入KNO3固体、等(任写一条)。10. 工业上使用一种国产低温催化剂生产氢气的反应过程如图所示
(1)、当温度为10℃时,KNO3、NaCl和H3BO3三种物质的溶解度由大到小的顺序为(用序号作答)。(2)、当温度为t℃时,在三种物质的饱和溶液中溶质的质量分数由大到小的顺序为(用序号作答)。(3)、要将P点处的KNO3溶液变成饱和溶液,可采取的措施有:加入KNO3固体、等(任写一条)。10. 工业上使用一种国产低温催化剂生产氢气的反应过程如图所示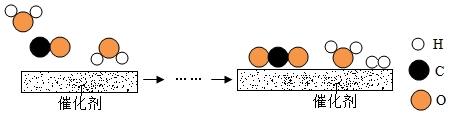 (1)、该微观反应过程中出现了种氧化物。(2)、参加反应的
(1)、该微观反应过程中出现了种氧化物。(2)、参加反应的 与
与  分子个数之比为。 (3)、该反的化学方程式为。
分子个数之比为。 (3)、该反的化学方程式为。三、推断题
-
11. 下列A~H都是初中化学中常见的物质。已知A是沼气、可燃冰的重要成分,F可用于改良酸性土壤,它们之间的转化关系如下图所示。

回答下列问题:
(1)、A的化学式为 , G俗称。(2)、大气中D的含量过高会产生 , 从而导致全球气候变暖。(3)、反应③的化学方程式为 , 该反应过程中(填“吸收”或“放出”)热量。(4)、反应④的化学方程式为 , 其基本反应类型为反应。四、实验题
-
12. 实验室利用下图所示装置进行相关实验。

回答下列问题:
(1)、写出装置图中标号仪器的名称:① , ②。(2)、用高锰酸钾制氧气,应选用的发生装置是(填字母序号),该反应的化学方程式为 , 其中转化为氧气的氧元素与高锰酸钾中氧元素的质量之比是。(3)、常温下,用锌和稀硫酸反应制取氢气,若要随时控制反应的发生和停止,应选用的发生装置是(填字母序号),反应的化学方程式为;点燃氢气前必须验纯,为确保安全,最好选用装置(填字母序号)所示方法收集氢气。五、科学探究题
-
13. 某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。(1)、[查阅资料]
经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学方程式为。
(2)、[对比实验]编号
操作
现象
甲
将表面未打磨的铝丝浸入CuSO4溶液中
无明显现象
乙
将表面打磨后的铝丝浸入CuSO4溶液中
铝丝表面析出红色固体
丙
将表面未打磨的铝丝浸入CuCl2溶液中
铝丝表面析出红色固体
比较实验乙和实验(填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(3)、实验乙中反应的化学方程式为 , 据此可知金属活动性Al比Cu(填“强”或“弱”)。(4)、小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是。(5)、[猜测与探究]小组同学针对实验丙的现象,经讨论后猜测:Cl-破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
操作
现象
结论
推论
(1)向一支试管中再加入
NaCl固体
铝丝表面析
出红色固体
氧化铝薄膜
被破坏
Na+或①能
破坏氧化铝薄膜
(2)向另一支试管中再加入
Na2SO4固体
②
氧化铝薄膜
未被破坏
Na+和SO42-都不能
破坏氧化铝薄膜
(6)、[结论与反思]得出结论:前述猜测(填“正确”或“错误”)。总结反思:本次探究充分运用了比较法和控制变量法。
六、计算题
-
14. 为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取20g固体混合物置于烧杯中,将100g稀硫酸分为四等份依次加入其中进行实验,测得数据如下:
次序
①
②
③
④
加入稀硫酸的质量/g
25
25
25
25
剩余固体的质量/g
16
a
10
10
回答列问题:
(1)、原固体混合物中,氧化铜的质量分数为。(2)、上表中,a的值为 , 实验③所得溶液中的溶质是(填化学式)。(3)、该实验所用稀硫酸中溶质的质量分数为。(写出计算过程,结果精确到0.1%)
-
-
-