吉林省五地六市联盟2018-2019学年高二下学期化学期末考试试卷B卷
试卷更新日期:2019-07-17 类型:期末考试
一、选择题(总计20小题,1~10题,每小题2分,11~20题,每小题3分,每小题只有一个选项符合题意.)
-
1. 表示一个原子在第三个电子层上有10个电子可以写成( )A、3s10 B、3d10 C、3s23p63d2 D、3s23p53d32. X和Y是原子序数大于4的短周期元素,Xm+和Yn-两种离子的核外电子排布相同,下列说法中,正确的是( )A、X的原子半径比Y小 B、X和Y的核电荷数之差为m-n C、电负性:X>Y D、第一电离能:X<Y3. 下列说法正确的是( )A、原子晶体中只存在非极性共价键 B、干冰升华时,分子内共价键不会发生断裂 C、因为HCl的相对分子质量大于HF,所以HCl的熔点高于HF D、金属元素和非金属元素形成的化合物一定是离子化合物4. 下列叙述中正确的是( )A、NH3、CO、CO2都是极性分子 B、CH4、CCl4都是含有极性键的非极性分子 C、HF、HCl、HBr、HI的稳定性依次增强 D、CS2、H2O、C2H2都是直线形分子5. 下列化合物,按熔点由高到低排列正确的是( )A、SiO2、CsCl、CBr4、CF4 B、HF、H2O、H2S、CH4 C、SiC、晶体硅、金刚石、SiO2 D、CsCl、KCl、CaO、MgO6. 已知X、Y、Z三种元素组成的化合物是团簇分子,其结构如图所示,则下面表示该化合物的化学式正确的( )
 A、ZXY3 B、ZX2Y6 C、ZX4Y8 D、ZX8Y127. “纳米材料”是指粒子直径在1~100nm之间的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,对所形成的分散系说法正确的是:(1)是溶液;(2)是胶体;(3)能产生丁达尔效应;(4)能通过滤纸;(5)不能通过滤纸;(6)静置后会析出黑色的沉淀。A、(1)(4)(6) B、(2)(3)(4) C、(2)(3)(5) D、(3)(4)(6)8. 下列各组离子能在pH=1的无色溶液中大量共存的是( )A、K+、Cl-、HCO3-、SO42- B、Mg2+、Cl-、Al3+、SO42- C、Ca2+、Fe3+、Na+、NO3- D、Ba2+、Cl-、Na+、CO32-9. 下列说法正确的是( )A、浓H2SO4具有强氧化性,常温下就能与金属Cu发生剧烈反应 B、金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 C、少量的CO2通入NaClO溶液中发生反应:NaClO + CO2 + H2O = NaHCO3 + HClO D、NO2与H2O反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为1:210. 下列有关物质用途的说法中,正确的是( )
A、ZXY3 B、ZX2Y6 C、ZX4Y8 D、ZX8Y127. “纳米材料”是指粒子直径在1~100nm之间的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,对所形成的分散系说法正确的是:(1)是溶液;(2)是胶体;(3)能产生丁达尔效应;(4)能通过滤纸;(5)不能通过滤纸;(6)静置后会析出黑色的沉淀。A、(1)(4)(6) B、(2)(3)(4) C、(2)(3)(5) D、(3)(4)(6)8. 下列各组离子能在pH=1的无色溶液中大量共存的是( )A、K+、Cl-、HCO3-、SO42- B、Mg2+、Cl-、Al3+、SO42- C、Ca2+、Fe3+、Na+、NO3- D、Ba2+、Cl-、Na+、CO32-9. 下列说法正确的是( )A、浓H2SO4具有强氧化性,常温下就能与金属Cu发生剧烈反应 B、金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 C、少量的CO2通入NaClO溶液中发生反应:NaClO + CO2 + H2O = NaHCO3 + HClO D、NO2与H2O反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为1:210. 下列有关物质用途的说法中,正确的是( )①Ca(ClO)2可用于杀菌、消毒 ②液氨可用作致冷剂
③Fe2O3常用作红色油漆和涂料 ④SO2可用来漂白馒头、银耳等食品
A、①③ B、①② C、①②③ D、都正确11. 下列常见分子中σ键、π键判断正确的是( )A、CN-与N2结构相似,CH2=CHCN分子中σ键与π键数目之比为1:1 B、CO与N2结构相似,CO分子中σ键与π键数目之比为2:1 C、C22-与O22+互为等电子体,1mol O22+中含有的π键数目为2NA D、已知反应N2O4(l) + 2N2H4(l) = 3N2(g) + 4H2O(l),若该反应中有4molN-H键断裂,则形成的π键数目为6 NA12. 下列关于晶体的说法正确的组合是( )①分子晶体中都存在共价键; ②在晶体中只要有阳离子就一定有阴离子;
③金刚石、NaF、NaCl、H2O、H2S晶体的熔点依次降低;
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键;
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti3+和12个O2-相邻;
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合;
⑦晶体中分子间作用力越大,分子越稳定;
⑧氯化钠熔化是离子键被破坏
 A、①②③⑥ B、①②④ C、③⑤⑦ D、③⑤⑧13. Co(Ⅲ)的八面体配合物CoClm·nNH3 , 若1 mol配合物与AgNO3作用生成1 mol AgCl沉淀,则m、n的值是( )A、m=1,n=5 B、m=4,n=5 C、m=5,n=1 D、m=3,n=414. 若NA代表阿伏加德罗常数,则下列叙述正确的是( )A、1 mol/L的氨水与等质量的水混合后(忽略体积变化),所得溶液浓度大于0.5 mol/L B、1 mol Na2O2与足量的水完全反应,转移的电子数为2NA C、在标准状况下,22.4 L氢气与22.4 L氦气所含有的原子数均为2NA D、28 g乙烯和环丙烷(C3H6)的混合气体含有的原子总数为3NA15. 下列离子方程式的书写正确的是( )A、二氧化硫通入氯化铁溶液:SO2 + 2Fe3+ + 4H+ = SO42- + 2Fe2+ + 2H2O B、澄清石灰水与过量的小苏打溶液反应:Ca2+ + OH- + HCO3- = CaCO3↓ + H2O C、向NaHSO4溶液中滴加Ba(OH)2溶液至刚好沉淀完全: 2H+ + SO42- + 2OH- = BaSO4↓ + 2H2O D、向含有硫酸钙的水垢中加入饱和碳酸钠溶液:CaSO4 + CO32- = CaCO3 + SO42-16. 某矿石样品中可能含铁,为确定其成分,进行如下操作:
A、①②③⑥ B、①②④ C、③⑤⑦ D、③⑤⑧13. Co(Ⅲ)的八面体配合物CoClm·nNH3 , 若1 mol配合物与AgNO3作用生成1 mol AgCl沉淀,则m、n的值是( )A、m=1,n=5 B、m=4,n=5 C、m=5,n=1 D、m=3,n=414. 若NA代表阿伏加德罗常数,则下列叙述正确的是( )A、1 mol/L的氨水与等质量的水混合后(忽略体积变化),所得溶液浓度大于0.5 mol/L B、1 mol Na2O2与足量的水完全反应,转移的电子数为2NA C、在标准状况下,22.4 L氢气与22.4 L氦气所含有的原子数均为2NA D、28 g乙烯和环丙烷(C3H6)的混合气体含有的原子总数为3NA15. 下列离子方程式的书写正确的是( )A、二氧化硫通入氯化铁溶液:SO2 + 2Fe3+ + 4H+ = SO42- + 2Fe2+ + 2H2O B、澄清石灰水与过量的小苏打溶液反应:Ca2+ + OH- + HCO3- = CaCO3↓ + H2O C、向NaHSO4溶液中滴加Ba(OH)2溶液至刚好沉淀完全: 2H+ + SO42- + 2OH- = BaSO4↓ + 2H2O D、向含有硫酸钙的水垢中加入饱和碳酸钠溶液:CaSO4 + CO32- = CaCO3 + SO42-16. 某矿石样品中可能含铁,为确定其成分,进行如下操作:
下列有关说法正确的是( )
A、向溶液乙中滴加KSCN溶液,溶液颜色变红,则原矿石样品中存在Fe3+ B、向溶液甲中滴加KSCN溶液,溶液颜色变红,则原矿石样品中存在Fe3+ C、向溶液乙中滴加少量氢氧化钠溶液,一定出现红褐色沉淀 D、该矿石一定为赤铁矿17. 某混合气体中可能含有Cl2,O2,SO2,NO,NO2中的两种或多种气体.现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成分的判断中正确的是( )A、肯定有SO2和NO B、肯定没有Cl2和NO2 , 一定有O2 C、可能有Cl2和O2 D、肯定只有NO18. 甲、乙两烧杯中分别装有相同体积、相同物质的量浓度的氨水和NaOH溶液,各加入10mL0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是( )A、甲中沉淀一定比乙中的多 B、甲中沉淀可能比乙中的多 C、甲中和乙中的沉淀不可能一样 D、甲中沉淀一定比乙中的少19. 工业废气中氮氧化合物是造成大气污染的主要物质。为了治理污染,工业上通常通入NH3与废气发生下列反应;NOx + NH3 → N2 + H2O。现有3L由NO和NO2组成的混合气体,可用同温同压下3.5 L NH3恰好使其完全转化为N2。则原混合气体中NO和NO2的物质的量之比为( )A、1:1 B、2:1 C、1:3 D、1:420. 用20 mL 18.4 mol/L的浓H2SO4与铜共热一段时间后,冷却,过滤除去多余的铜,将滤液加水稀释到100 mL,所得溶液中SO2的浓度为3.18 mol/L,则此时溶液中CuSO4的物质的量浓度为( )
A、0.50 mol/L B、0.75 mol/L C、1.00 mol/L D、3.18 mol/L二、填空题(总计4小题)
-
21. 学习化学应该明确“从生活中来,到生活中去”道理。在生产生活中,我们会遇到各种各样的化学反应。请按要求回答下列问题:(1)、写出下列反应的化学方程式。(注意反应条件并配平)
①镁带着火时,不能用液态CO2灭火剂来灭火的原因是。
②工业上用氯气和消石灰(氢氧化钙乳浊液)反应制取漂白粉。
(2)、请你写出下列反应的离子方程式。①胃舒平含有氢氧化铝,可用来治疗胃酸(盐酸)过多。
②电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(3)、写出工业上生产半导体材料硅,在制备粗硅时反应的化学方程式:(4)、铝热反应在工业生产中的重要用途之一是 。22. A,B,C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。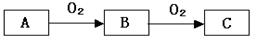 (1)、若A是一种黄色单质固体,则B→C的化学方程式为。(2)、若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质与二氧化碳气体的反应。将C长期露置于空气中,最后将变成物质D。现有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38 g,D的质量分数为。(3)、若C是红棕色气体,A可能是一种能使湿润的红色石蕊试纸变蓝的气体。下图是实验室制取A气体的装置,请结合所学知识,回答下列问题:
(1)、若A是一种黄色单质固体,则B→C的化学方程式为。(2)、若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质与二氧化碳气体的反应。将C长期露置于空气中,最后将变成物质D。现有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38 g,D的质量分数为。(3)、若C是红棕色气体,A可能是一种能使湿润的红色石蕊试纸变蓝的气体。下图是实验室制取A气体的装置,请结合所学知识,回答下列问题:
①验证A是否已经收集满的方法是(任写一种)。
②若有5.35g氯化铵参加反应,则产生的A气体在标准状况下的体积为L。
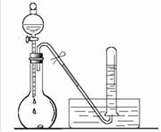
③试写出C与水反应的化学方程式 , 反应可得到酸X。如下图:足量X的浓溶液与Cu反应,写出烧瓶中发生反应的离子方程式。实验完毕后,试管中收集到的气体的主要成分为(写化学式)
 23. 聚合硫酸铁是一种新型高效净水剂。以黄铁矿(主要成分:FeS2 , 铁的化合价为+2价)烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁(铁的化合价为+3价)的实验步骤如下:
23. 聚合硫酸铁是一种新型高效净水剂。以黄铁矿(主要成分:FeS2 , 铁的化合价为+2价)烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁(铁的化合价为+3价)的实验步骤如下:
回答下列问题:
(1)、“煅烧”过程发生反应的氧化产物是。(2)、写出“酸浸”过程中发生反应的离子方程式。(3)、“氧化”过程中先产生无色气体,最终变成红棕色气体,写出加入NaNO3产生无色气体反应的离子方程式 , 若用H2O2代替NaNO3达到相同氧化效果,消耗H2O2和NaNO3的物质的量之比。(4)、为确定产品是否合格,需测定聚合硫酸铁中Fe3+和SO42-的物质的量之比,测定时需要的试剂为___________ (填写序号)。A、FeSO4 B、BaCl2 C、NaOH D、NaCl24. Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。(1)、基态Co原子的价电子排布式为 , Co3+核外3d能级上有对成对电子。
(2)、Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+ 的配位数是 , 1mol 配离子中所含σ键的数目为 , 配位体N3-中心原子杂化类型为。(3)、Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+ ,其原因是。(4)、某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN- , K+位于立方体的某恰当位置上。据此可知该晶体的化学式为 , 立方体中Fe2+间连接起来形成的空间构型是。(5)、NiO的晶体结构如图甲所示,其中离子坐标参数A 为(0,0,0),B为(1,1,0),则C离子坐标参数为。 (6)、一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为g(用含a、NA的代数式表示)。
(6)、一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为g(用含a、NA的代数式表示)。