安徽省滁州市2018-2019学年高一下学期化学6月月考试卷
试卷更新日期:2019-07-10 类型:月考试卷
一、单选题(共16小题每小题3.0分,共48分)
-
1. 如果家中的食用花生油不小心混入了大量的水,最简便的分离方法是( )A、
 B、
B、 C、
C、 D、
D、 2. 元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语。下列有关化学用语的表示方法中错误的是( )A、次氯酸的电子式
2. 元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语。下列有关化学用语的表示方法中错误的是( )A、次氯酸的电子式 B、S2-的结构示意图:
B、S2-的结构示意图:  C、O18的原子符号:
D、CO2分子的结构式:O=C=O
3. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
C、O18的原子符号:
D、CO2分子的结构式:O=C=O
3. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( ) A、反应开始到10s,用Z表示的反应速率为0.158mol·L-1·s-1 B、10s后,该反应停止进行 C、反应的化学方程式为2X(g)+Y(g) 2Z(g) D、0~10s的时间内的平均反应速率:v(X)=v(Y)=0.0395 mol·L-1·s-14. 在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),5s达到平衡。达到平衡时,生成了2molC,经测定D的浓度为0.5mol·L-1 , 下列判断正确的是( )A、x=1 B、B的转化率为20% C、平衡时A的浓度为150mol·L-1 D、B的平均反应速率为0.2mol·L-15. 如图是甲醇(CH3OH)燃料电池的化学原理示意图,下列判断不正确的是( )
A、反应开始到10s,用Z表示的反应速率为0.158mol·L-1·s-1 B、10s后,该反应停止进行 C、反应的化学方程式为2X(g)+Y(g) 2Z(g) D、0~10s的时间内的平均反应速率:v(X)=v(Y)=0.0395 mol·L-1·s-14. 在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),5s达到平衡。达到平衡时,生成了2molC,经测定D的浓度为0.5mol·L-1 , 下列判断正确的是( )A、x=1 B、B的转化率为20% C、平衡时A的浓度为150mol·L-1 D、B的平均反应速率为0.2mol·L-15. 如图是甲醇(CH3OH)燃料电池的化学原理示意图,下列判断不正确的是( ) A、电极A为电池负极 B、电极B表面上发生还原反应 C、工作一段时间溶液pH保持不变 D、燃料电池工作时不会出现火焰6. 纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和Ag2O,用KOH溶液作电解质溶液,电池的总反应为Zn+Ag2O=2Ag+ZnO。关于该电池下列叙述不正确的是( )A、正极的电极反应为Ag2O+2e-+H2O=2Ag+2OH- B、Zn极发生氧化反应,Ag2O极发生还原反应 C、使用时电子由Zn极经外电路流向Ag2O极,Zn是负极 D、使用时溶液中电流的方向是由Ag2O极流向Zn极7. 下列反应属于加成反应的是( )A、CH3CH=CH2+Br2→
A、电极A为电池负极 B、电极B表面上发生还原反应 C、工作一段时间溶液pH保持不变 D、燃料电池工作时不会出现火焰6. 纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和Ag2O,用KOH溶液作电解质溶液,电池的总反应为Zn+Ag2O=2Ag+ZnO。关于该电池下列叙述不正确的是( )A、正极的电极反应为Ag2O+2e-+H2O=2Ag+2OH- B、Zn极发生氧化反应,Ag2O极发生还原反应 C、使用时电子由Zn极经外电路流向Ag2O极,Zn是负极 D、使用时溶液中电流的方向是由Ag2O极流向Zn极7. 下列反应属于加成反应的是( )A、CH3CH=CH2+Br2→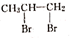 B、
B、 +HNO3
+HNO3 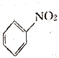 +H2O
C、2CH3CH2OH+O2 2CH3CHO+2H2O
D、CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
8. X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。有关下列叙述正确的是( )A、X肯定为碱金属元素 B、Y、Z两元素形成的化合物熔点较低 C、X、Y两元素形成的化合物不可能为离子化合物 D、稳定性:Y的氢化物>Z的氢化物9. 下列图示变化为吸热反应的是( )A、
+H2O
C、2CH3CH2OH+O2 2CH3CHO+2H2O
D、CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
8. X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。有关下列叙述正确的是( )A、X肯定为碱金属元素 B、Y、Z两元素形成的化合物熔点较低 C、X、Y两元素形成的化合物不可能为离子化合物 D、稳定性:Y的氢化物>Z的氢化物9. 下列图示变化为吸热反应的是( )A、 B、
B、 C、
C、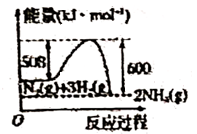 D、
D、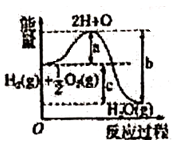 10. 某温度下,反应2N2O5(g) 4NO2(g)+O2(g)开始时,c(N2O5)=0.0408mol·L-1 , 经1min后,c(N2O5)=0.0300mol·L-1。则该反应的反应速率为( )A、v(N2O5)=5.4x10-3mol·L-1·mini-1 B、v(N2O5)=1.08x10-2mol·L-1·min-1 C、v(NO2)=1.08x10-2mol·L-1·min-1 D、v(O2)=1.08x10-2mol·L-1·min-111. 山梨酸是一种常用的食品防腐剂,其结构为CH3-CH=CH-CH=CH-COOH。下列关于山梨酸性质的叙述中,不正确的是( )A、可与钠反应 B、可与碳酸钠溶液反应 C、可与溴的四氯化碳溶液发生取代反应 D、可生成高分子化合物12. 区别羊毛和棉花最简便的方法是( )A、加入碘水 B、浸入水中 C、加稀硫酸水解 D、火上灼烧闻气味13. 下列变化过程,能放出热量的过程有( )
10. 某温度下,反应2N2O5(g) 4NO2(g)+O2(g)开始时,c(N2O5)=0.0408mol·L-1 , 经1min后,c(N2O5)=0.0300mol·L-1。则该反应的反应速率为( )A、v(N2O5)=5.4x10-3mol·L-1·mini-1 B、v(N2O5)=1.08x10-2mol·L-1·min-1 C、v(NO2)=1.08x10-2mol·L-1·min-1 D、v(O2)=1.08x10-2mol·L-1·min-111. 山梨酸是一种常用的食品防腐剂,其结构为CH3-CH=CH-CH=CH-COOH。下列关于山梨酸性质的叙述中,不正确的是( )A、可与钠反应 B、可与碳酸钠溶液反应 C、可与溴的四氯化碳溶液发生取代反应 D、可生成高分子化合物12. 区别羊毛和棉花最简便的方法是( )A、加入碘水 B、浸入水中 C、加稀硫酸水解 D、火上灼烧闻气味13. 下列变化过程,能放出热量的过程有( )①液态水变成水蒸气②酸碱中和反应③浓硫酸稀释④固体氢氧化钠溶于水⑤H2在Cl2中燃烧⑥灼热的炭与CO2的反应⑦NH4Cl晶体与BaOH2·8H2O混合搅拌
A、2个 B、3个 C、4个 D、5个14. 如图将锌片和铜片用导线连接后放入稀硫酸中,发生原电池反应,下列叙述错误的是( ) A、溶液的pH增大 B、溶液中的Zn2+浓度增大 C、溶液中的SO42-浓度增大 D、溶液的密度增大15. 在反应C(s)+CO2(g)=2CO(g)中,可使反应速率增大的措施是( )
A、溶液的pH增大 B、溶液中的Zn2+浓度增大 C、溶液中的SO42-浓度增大 D、溶液的密度增大15. 在反应C(s)+CO2(g)=2CO(g)中,可使反应速率增大的措施是( )①增大压强②升高温度③通入CO2④增加碳的量⑤用等量炭粉代替焦炭
A、①②③ B、②③④⑤ C、①②③⑤ D、②③④16. 如图为从海带中提取碘的工业生产流程,下列有关说法错误的是( ) A、因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘元素 B、碱化操作时,加入NaOH溶液的目的是在碱性溶液中,可溶性有机物质可形成沉淀 C、在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等 D、在实验室进行过滤操作时,需要用到的玻璃仪器有玻璃捧、烧杯、漏斗
A、因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘元素 B、碱化操作时,加入NaOH溶液的目的是在碱性溶液中,可溶性有机物质可形成沉淀 C、在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等 D、在实验室进行过滤操作时,需要用到的玻璃仪器有玻璃捧、烧杯、漏斗二、填空题(共42分)
-
17. 元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089nm)
元素代号
A
B
C
D
E
原子半径/mm
0.16
0.143
0.102
0.099
0.074
主要化合价
+2
+3
+6、-2
-1
-2
(1)、用元素代号标出它们在周期表中的对应位置(以下为周期表的一部分) (2)、B元素处于周期表中第周期第族。(3)、B的最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的离子方程式。(4)、上述五种元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式)。(5)、C,E形成的化合物为(填化学式)18. 原电池原理的发现是储能和供能技术的大进步是化学对人类的一项重大贡献。(1)、将纯锌片和纯铜片按图方式插入10mL相同浓度的稀硫酸中一段时间,回答下列问题:
(2)、B元素处于周期表中第周期第族。(3)、B的最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的离子方程式。(4)、上述五种元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式)。(5)、C,E形成的化合物为(填化学式)18. 原电池原理的发现是储能和供能技术的大进步是化学对人类的一项重大贡献。(1)、将纯锌片和纯铜片按图方式插入10mL相同浓度的稀硫酸中一段时间,回答下列问题: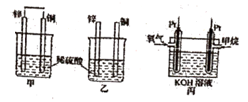
①下列说法正确的是。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲乙(填 “>”“<”或“=” )
③请写出图中构成原电池的负极电极反应式:。
④当甲中溶液质量增重31.5g时,电极上转移电子数目为。
(2)、图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的电极反应方程式为。19. 某温度下,在2L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1min时达到平衡。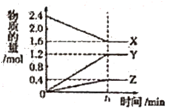 (1)、请写出该反应的化学方程式: 。(2)、若上述反应中X、Y、Z分别为NH3、H2、N2 , 且已知1mol氨气分解成氮气和氢气要吸收46KJ的热量,则至t1min时,该反应吸收的热量为 ;在0~t1min时间内,用H2表示该反应的平均速率v(H2)为 。下列叙述能判断该反应达到平衡状态的是 (填字母)。
(1)、请写出该反应的化学方程式: 。(2)、若上述反应中X、Y、Z分别为NH3、H2、N2 , 且已知1mol氨气分解成氮气和氢气要吸收46KJ的热量,则至t1min时,该反应吸收的热量为 ;在0~t1min时间内,用H2表示该反应的平均速率v(H2)为 。下列叙述能判断该反应达到平衡状态的是 (填字母)。A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
20. 有下列3种有机化合物A:CH2=CH2、B: 、C:CH3COOH. (1)、写出化合物A、C中官能团的名称: 、 。(2)、3种化合物中能使溴的四氯化碳溶液褪色的是(写名称),该反应的化学方程式为 。(3)、B的名称是 , 它的分子具有 (填分子构型)结构,是否存在单双键交替结构?(填“是”或“否“)。21. 溴有“海洋元素”之称,海水中溴含量为65mg·L-1 , 实验室模拟海水中溴的提取。
、C:CH3COOH. (1)、写出化合物A、C中官能团的名称: 、 。(2)、3种化合物中能使溴的四氯化碳溶液褪色的是(写名称),该反应的化学方程式为 。(3)、B的名称是 , 它的分子具有 (填分子构型)结构,是否存在单双键交替结构?(填“是”或“否“)。21. 溴有“海洋元素”之称,海水中溴含量为65mg·L-1 , 实验室模拟海水中溴的提取。实验方法:将适量新制氯水加入到20mL富含溴离子的海水中(海水可以用01mol·L-1的溴化钠溶液代替),把溴置换出来
(1)、氯水中的氯气作 剂,涉及反应的离子方程式为 .(2)、得到的单质溴可以用有机溶剂在 (仪器)中实现萃取富集。