湖南省2018-2019学年高考化学三模考试试卷
试卷更新日期:2019-06-18 类型:高考模拟
一、选择题(本题包括22小题,每小题2分,共44分。在每小题给出的四个选项中,只有一项是符合题目要求的)
-
1. 下列古代发明的应用过程中,不涉及化学变化的是()A、活字印刷 B、火药使用 C、陶器烧制 D、粮食酿酒2. 古丝绸之路贸易的下列商品中,主要成分属于无机物的是()A、草药 B、茶叶 C、丝绸 D、瓷器3. 笔墨纸砚是中国独有的文书工具,即文房四宝。纸的主要成分是()A、纤维素 B、淀粉 C、蛋白质 D、橡胶4. 胶体是日常生活中常见的分散系。下列分散系属于胶体的是()A、矿泉水 B、稀鸡蛋清水溶液 C、生理盐水 D、葡萄糖溶液5. 下列仪器名称为“容量瓶”的是()A、
 B、
B、 C、
C、 D、
D、 6. 下列化学用语表示正确的是()A、水的电子式:
6. 下列化学用语表示正确的是()A、水的电子式: B、氯离子的结构示意图:
B、氯离子的结构示意图:  C、胆矾的化学式:CuSO4
D、乙醇的结构简式:C2H6O
7. 下列气体中,能使湿润的红色石蕊试纸变蓝的是()A、CO B、SO2 C、NH3 D、HCl8. 下列物质既能与盐酸反应,又能与氢氧化钠溶液反应的是()A、Cu B、Al2O3 C、稀盐酸 D、SiO29. 下列物质中,不能用两种单质直接化合而成的是()A、NO B、CuCl2 C、CO2 D、FeCl210. 硒(Se)元素是人体必需的微量元素。Se具有抗癌作用,其原子核内的中子数是()A、11 B、34 C、45 D、7911. 下列物质中,只含有离子键的是()A、H2O B、CO2 C、MgCl2 D、NaOH12. 下列物质不能作为漂白剂的是()A、SO2 B、Ca(ClO)2 C、稀盐酸 D、新制氯水13. 设NA为阿伏加德罗常数的值。11.2LCH4(标准状况)中所含氢原子的数目是()A、0.5NA B、NA C、1.5NA D、2NA14. 将40gNaOH溶于水配成1L溶液,则该溶液中OH-的物质的量浓度是()A、0.5mol·L-1 B、1.0mol·L-1 C、1.5mol·L-1 D、2.0mol·L-115. 下列物质中,能通过化学反应使溴的四氯化碳溶液褪色的是()A、CH4 B、CH2=CH2 C、CH3CH2OH D、苯16. 在含有大量Na+、CO32- 、Cl-的溶液中,还可能大量共存的离子是()
C、胆矾的化学式:CuSO4
D、乙醇的结构简式:C2H6O
7. 下列气体中,能使湿润的红色石蕊试纸变蓝的是()A、CO B、SO2 C、NH3 D、HCl8. 下列物质既能与盐酸反应,又能与氢氧化钠溶液反应的是()A、Cu B、Al2O3 C、稀盐酸 D、SiO29. 下列物质中,不能用两种单质直接化合而成的是()A、NO B、CuCl2 C、CO2 D、FeCl210. 硒(Se)元素是人体必需的微量元素。Se具有抗癌作用,其原子核内的中子数是()A、11 B、34 C、45 D、7911. 下列物质中,只含有离子键的是()A、H2O B、CO2 C、MgCl2 D、NaOH12. 下列物质不能作为漂白剂的是()A、SO2 B、Ca(ClO)2 C、稀盐酸 D、新制氯水13. 设NA为阿伏加德罗常数的值。11.2LCH4(标准状况)中所含氢原子的数目是()A、0.5NA B、NA C、1.5NA D、2NA14. 将40gNaOH溶于水配成1L溶液,则该溶液中OH-的物质的量浓度是()A、0.5mol·L-1 B、1.0mol·L-1 C、1.5mol·L-1 D、2.0mol·L-115. 下列物质中,能通过化学反应使溴的四氯化碳溶液褪色的是()A、CH4 B、CH2=CH2 C、CH3CH2OH D、苯16. 在含有大量Na+、CO32- 、Cl-的溶液中,还可能大量共存的离子是()
A、Ba2+ B、NO3- C、Ag+ D、H+17. 下列反应的离子方程式书写正确的是()A、氯化铁与铁粉的反应:Fe3++Fe=2Fe2+ B、氢氧化铜与稀硫酸的反应:OH-+H+=H2O C、金属钠与水的反应:2Na+2H2O=2Na++2OH-+H2↑ D、铜与浓硝酸的反应:3Cu+8H++2NO =3Cu2++2NO↑+4H2O18. 下列有机反应属于加成反应的是()A、CH4+2O2 CO2+2H2O B、CH2=CH2+HCl CH3CH2Cl C、 +Br2
+Br2  +HBr
D、CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
19. 一定条件下,反应2SO2+O2 2SO3 , 在密闭容器中进行。下列有关说法错误的是()A、使用催化剂能增大反应速率 B、该条件下,SO2能全部转化为SO3 C、达到平衡后,各物质的浓度不再变化 D、增大O2的浓度可加快SO2的反应速率20. 下列反应中,能量变化与图一致的是()
+HBr
D、CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
19. 一定条件下,反应2SO2+O2 2SO3 , 在密闭容器中进行。下列有关说法错误的是()A、使用催化剂能增大反应速率 B、该条件下,SO2能全部转化为SO3 C、达到平衡后,各物质的浓度不再变化 D、增大O2的浓度可加快SO2的反应速率20. 下列反应中,能量变化与图一致的是() A、木炭燃烧 B、过氧化钠与水反应 C、氢氧化钠溶液与盐酸反应 D、NH4Cl晶体与Ba(OH)2·8H2O晶体反应过程21. 下列实验能达到实验目的的是()A、用分液漏斗从食盐水中分离出NaCl B、用氯水除去FeCl2溶液中少量的FeCl3 C、用NaOH 溶液除去Cl2中少量的HCl D、用KSCN溶液检验某溶液中是否含有Fe3+22. 图为铜一锌一稀硫酸原电池示意图,下列说法正确的是()
A、木炭燃烧 B、过氧化钠与水反应 C、氢氧化钠溶液与盐酸反应 D、NH4Cl晶体与Ba(OH)2·8H2O晶体反应过程21. 下列实验能达到实验目的的是()A、用分液漏斗从食盐水中分离出NaCl B、用氯水除去FeCl2溶液中少量的FeCl3 C、用NaOH 溶液除去Cl2中少量的HCl D、用KSCN溶液检验某溶液中是否含有Fe3+22. 图为铜一锌一稀硫酸原电池示意图,下列说法正确的是() A、电子由铜片通过导线流向锌片 B、锌为负极,铜为正极 C、锌得电子,被还原 D、该装置能将电能转化为化学能
A、电子由铜片通过导线流向锌片 B、锌为负极,铜为正极 C、锌得电子,被还原 D、该装置能将电能转化为化学能二、填空题:本题包括4小题,每空2分,共26分。
-
23. 现有以下四种物质:①明矾②苯③三氧化二铁④蛋白质
根据题意,选择合适的序号填空:
(1)、要使浑浊的水变澄清,可使用。(2)、由煤干馏制取,是重要的有机溶剂,在居室装修中可造成空气污染的是 。(3)、可做红色涂料的是 。(4)、在酶等催化剂作用下水解生成氨基酸的是。24. 根据所学的知识填空。(1)、实验室用锌粒与稀硫酸反应制取H2 , 要加快产生H2的速率,可采用的方法是(任写一种)。(2)、FeCl2溶液滴入KSCN溶液,出现红色,向变色的溶液中加入铁粉,溶液颜色变浅,直至褪色。原因是Fe3+被铁粉还原生成了Fe2+ , 写出该反应的离子方程式: 。(3)、洁厕灵(主要成分是盐酸)与84消毒液(主要成分是次氯酸钠)是家庭生活中常备的两种清洁剂,但两种液体不能混合使用,两者混合会产生有毒气体Cl2 , 其发生的化学反应方程式为2HCl+NaClO=NaCl+Cl2↑+H2O。当有1mol的HCl参加反应时生成的氯气在标准状况下的体积为L。
25. 乙烯、苯、乙醇、乙酸是重要的有机化工原料和生活中常见的有机物。(1)、乙烯使酸性KMnO4溶液褪色发生了(填“氧化”或“加成”)反应。(2)、苯和浓硝酸在浓硫酸作用下发生反应: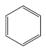 +HNO3 +H2O(请将反应方程式补充完整)。(3)、金属钠和乙醇、乙酸反应能生成 (填“H2”或“O2”)。26. 下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。
+HNO3 +H2O(请将反应方程式补充完整)。(3)、金属钠和乙醇、乙酸反应能生成 (填“H2”或“O2”)。26. 下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。 (1)、②、⑥两元素的气态氢化物中更稳定的是 (写化学式)。(2)、在上述六种元素中,原子半径最大的是(写元素符号)。(3)、写出①的气态氢化物与它的最高价氧化物对应的水化物发生反应的离子方程式为。
(1)、②、⑥两元素的气态氢化物中更稳定的是 (写化学式)。(2)、在上述六种元素中,原子半径最大的是(写元素符号)。(3)、写出①的气态氢化物与它的最高价氧化物对应的水化物发生反应的离子方程式为。三、实验题:本题包括1小题,每空2分,共10分。
-
27. 在实验室中用二氧化锰和浓盐酸反应制备纯净干燥的氯气,装置图如图所示。制备氯气的反应方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
 (1)、C中装有的试剂是 。(2)、D中所盛试剂是浓硫酸,作用是。(3)、E用的是排空气法收集气体(填“向上”或“向下”)。(4)、F中盛放的试剂是NaOH溶液,用于吸收多余的氯气,反应的离子方程式为。(5)、在上述反应中,每消耗0.4molHCl,生成的Cl2的质量为。
(1)、C中装有的试剂是 。(2)、D中所盛试剂是浓硫酸,作用是。(3)、E用的是排空气法收集气体(填“向上”或“向下”)。(4)、F中盛放的试剂是NaOH溶液,用于吸收多余的氯气,反应的离子方程式为。(5)、在上述反应中,每消耗0.4molHCl,生成的Cl2的质量为。四、选做题:请选修《化学与生活》的考生做第28题,选修《化学反应原理》的考生做第29题,并用2B铅笔在答题卡上相应位置填涂。注意所做题目的题号必须与所涂题目的题号一致,在答题卡选答区域指定位置答题。
-
28. 本题为《化学与生活》(选修1)选做题,每空2分,共20分。
请根据题意,选择恰当的选项用字母代号填空。
(1)、中国的高铁技术居于国际领先地位。①高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于。
A.金属材料B.无机非金属材料C.有机高分子材料
②高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是。
A.铜B.单质硅C.二氧化硅
③高铁轨道建设需用大量水泥。生产水泥的主要原料为黏土和 。
A.石灰石B.粗盐C.纯碱
④高铁轨道建设铺设的铁轨属于(填“金属铁”或“铁合金”)。
(2)、煤炭在我国能源结构中占有重要地位,合理使用有利于社会可持续发展。①控制燃煤产生的排放,能够减少硫酸型酸雨的形成。
②煤的气化和液化是实现能源清洁的重要途径。水煤气中CO和H2在加热、加压和催化剂存在条件下可以合成液体燃料(CH3OH),该反应的化学方程式为 , 煤的干馏属于(填“化学变化”或“物理变化”)。
(3)、营养均衡有利于身体健康。①人体内提供能量的主要营养物质为 、糖类和蛋白质。
②维生素是人体需要的营养物质。图为某品牌维生素C泡腾片说明书的部分内容。该泡腾片中添加的着色剂是。

③泡腾片溶于水时产生“沸腾”效果,是由于添加的酒石酸和 反应释放出了气体。
29. 本题为《化学反应原理》(选修4)选做题,每空2分,共20分。(1)、氢气是一种新型的绿色能源,又是一种重要的化工原料。①氢气燃烧热值高。实验测得,在常温常压下,1molH2完全燃烧生成液态水,放出285.8kJ热量。则表示H2燃烧热的热化学方程式是(填字母代号)。
A.H2(g)+ O2(g)=H2O(g) △H=+285.8kJ·mol-1
B.H2(g)+ O2(g)=H2O(1) △H=-285.8kJ·mol-1
C.H2(g)+ O2(g)=H2O(1) △H=+285.8kJ·mol-1
D.H2+ O2=H2O △H=-285.8kJ·mol-1
②氢氧燃料电池能量转化率高,具有广阔的发展前景。氢氧燃料电池中,发生还原反应的物质是(填“氢气”或“氧气”。
③氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1
反应达到平衡后,升高温度则反应速率(填“增大”或“减小”);平衡将向 (填“正反应方向”或“逆反应方向”)移动。
(2)、锌银电池能量大、电压平衡,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为Zn+Ag2O=ZnO+2Ag。请回答下列问题:①该电池的负极材料是;电池工作时,阳离子向 (填“正极”或“负极”)移动。
②电极材料锌可由闪锌矿在空气中般烧成氧化锌,然后用碳还原氧化锌来制取,该反应的化学方程式为ZnO+C Zn+CO↑,此法属 (填字母代号)。
A.电解法B.热还原法C.热分解法
(3)、常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:①混合溶液的pH=8的原因:(用离子方程式表示)。
②混合溶液中由水电离出的c(H+)(填“>“<”或“=’)0.1mol·L-1NaOH溶液中由水电离出的c(H+)。
③现有NaA与HA混合溶液,若pH=7,则溶液中c(Na+)c(A-)(填“>”“<”或“=”)。
-