2019年高考化学真题分类汇编专题06:无机物的转化、鉴别、除杂0
试卷更新日期:2019-06-14 类型:二轮复习
一、单选题
-
1. 下列实验不能达到目的的是( )
选项
目的
实验
A
制取较高浓度的次氯酸溶液
将Cl2通入碳酸钠溶液中
B
加快氧气的生成速率
在过氧化氢溶液中加入少量MnO2
C
除去乙酸乙酯中的少量乙酸
加入饱和碳酸钠溶液洗涤、分液
D
制备少量二氧化硫气体
向饱和亚硫酸钠溶液中滴加浓硫酸
A、A B、B C、C D、D2. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、NaCl(aq) Cl2(g) FeCl2(s) B、MgCl2(aq) Mg(OH)2(s) MgO (s) C、S(s) SO3(g) H2SO4(aq) D、N2(g) NH3(g) Na2CO3(s)3. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
结论
A
向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色
X溶液中一定含有Fe2+
B
向浓度均为0.05 mol·L−1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成
Ksp(AgI)> Ksp(AgCl)
C
向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色
Br2的氧化性比I2的强
D
用pH试纸测得:CH3COONa溶液的pH约为
9,NaNO2溶液的pH约为8
HNO2电离出H+的能力比CH3COOH的强
A、A B、B C、C D、D4. 下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( ) A、A B、B C、C D、D
A、A B、B C、C D、D二、实验探究题
-
5. 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
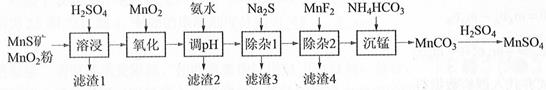
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
金属离子
Mn2+
Fe2+
Fe3+
Al3+
Mg2+
Zn2+
Ni2+
开始沉淀的pH
8.1
6.3
1.5
3.4
8.9
6.2
6.9
沉淀完全的pH
10.1
8.3
2.8
4.7
10.9
8.2
8.9
(1)、“滤渣1”含有S和;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式。(2)、“氧化”中添加适量的MnO2的作用是将。(3)、“调pH”除铁和铝,溶液的pH范围应调节为~6之间。(4)、“除杂1”的目的是除去Zn2+和Ni2+ , “滤渣3”的主要成分是。
(5)、“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是。
(6)、写出“沉锰”的离子方程式。(7)、层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2 , 其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=。6. 实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下: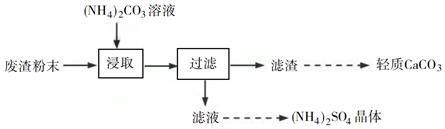 (1)、室温下,反应CaSO4(s)+ (aq)
(1)、室温下,反应CaSO4(s)+ (aq) CaCO3(s)+ (aq)达到平衡,则溶液中 =[Ksp(CaSO4)=4.8×10−5 , Ksp(CaCO3)=3×10−9]。 (2)、将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为;浸取废渣时,向(NH4)2CO3溶液中加入适量浓氨水的目的是。(3)、废渣浸取在如图所示的装置中进行。控制反应温度在60~70 ℃,搅拌,反应3小时。温度过高将会导致CaSO4的转化率下降,其原因是;保持温度、反应时间、反应物和溶剂的量不变,实验中提高CaSO4转化率的操作有。
CaCO3(s)+ (aq)达到平衡,则溶液中 =[Ksp(CaSO4)=4.8×10−5 , Ksp(CaCO3)=3×10−9]。 (2)、将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为;浸取废渣时,向(NH4)2CO3溶液中加入适量浓氨水的目的是。(3)、废渣浸取在如图所示的装置中进行。控制反应温度在60~70 ℃,搅拌,反应3小时。温度过高将会导致CaSO4的转化率下降,其原因是;保持温度、反应时间、反应物和溶剂的量不变,实验中提高CaSO4转化率的操作有。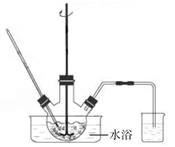 (4)、滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2]。7. 立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:(1)、利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。A、黄色 B、红色 C、紫色 D、绿色(2)、以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
(4)、滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2]。7. 立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:(1)、利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。A、黄色 B、红色 C、紫色 D、绿色(2)、以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的(填化学式)。
③沉淀器中反应的离子方程式为。
(3)、成品中S2−的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L−1的I2−KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L−1Na2S2O3溶液滴定,反应式为I2+2 =2I−+ 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为 , 样品中S2−的含量为(写出表达式)。三、综合题
-
8. 硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:

回答下列问题:
(1)、在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为。(2)、“滤渣1”的主要成分有。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是。(3)、根据H3BO3的解离反应:H3BO3+H2O H++B(OH)−4 , Ka=5.81×10−10 , 可判断H3BO3是酸;在“过滤2”前,将溶液pH调节至3.5,目的是。(4)、在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为 , 母液经加热后可返回工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是。9. 硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(1)、步骤①的目的是去除废铁屑表面的油污,方法是。(2)、步骤②需要加热的目的是 , 温度保持80~95 ℃,采用的合适加热方式是。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为(填标号)。 (3)、步骤③中选用足量的H2O2 , 理由是。分批加入H2O2 , 同时为了 , 溶液要保持pH小于0.5。(4)、步骤⑤的具体实验操作有 , 经干燥得到硫酸铁铵晶体样品。(5)、采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为。10. 化学小组实验探究 与 溶液的反应。(1)、实验一:用如下装置(夹持、加热仪器略)制备 ,将足量 通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
(3)、步骤③中选用足量的H2O2 , 理由是。分批加入H2O2 , 同时为了 , 溶液要保持pH小于0.5。(4)、步骤⑤的具体实验操作有 , 经干燥得到硫酸铁铵晶体样品。(5)、采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为。10. 化学小组实验探究 与 溶液的反应。(1)、实验一:用如下装置(夹持、加热仪器略)制备 ,将足量 通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。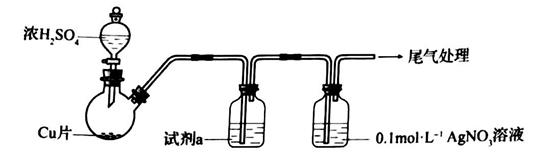
①浓 与Cu反应的化学方程式是
②试剂a是。
(2)、对体系中有关物质性质分析得出:沉淀B可能为 、 或二者混合物。(资料: 微溶于水; 难溶于水)
实验二:验证B的成分

①写出 溶于氨水的离子方程式:。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是 ,进而推断B中含有 。向滤液E中加入一种试剂,可进一步证实B中含有 。所用试剂及现象是。
(3)、根据沉淀F的存在,推测 的产生有两个途径:途径1:实验一中, 在 溶液中被氧化生成 ,随沉淀B进入D。
途径2:实验二中, 被氧化为 进入D。
实验三:探究 的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有;取上层清液继续滴加 溶液,未出现白色沉淀,可判断B中不含 。做出判断的理由:。
②实验三的结论:。
(4)、实验一中 与 溶液反应的离子方程式是。(5)、根据物质性质分析, 与 溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和SO42-生成。根据上述实验所得结论:。