2019年高考化学真题分类汇编专题07:化学平衡
试卷更新日期:2019-06-14 类型:二轮复习
一、单选题
-
1. 实验测得 溶液、 溶液以及 的pH随温度变化的曲线如图所示。下列说法正确的是( )
 A、随温度升高,纯水中 B、随温度升高, 的溶液的 减小 C、随温度升高, 的溶液的pH变化是 改变与水解平衡移动共同作用的结果 D、随水温升高, 溶液和 溶液的pH均降低,是因为 、 水解平衡移动方向不同
A、随温度升高,纯水中 B、随温度升高, 的溶液的 减小 C、随温度升高, 的溶液的pH变化是 改变与水解平衡移动共同作用的结果 D、随水温升高, 溶液和 溶液的pH均降低,是因为 、 水解平衡移动方向不同二、多选题
-
2. 在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
 A、反应2NO(g)+O2(g)=2NO2(g)的ΔH>0 B、图中X点所示条件下,延长反应时间能提高NO转化率 C、图中Y点所示条件下,增加O2的浓度不能提高NO转化率 D、380℃下,c起始(O2)=5.0×10−4 mol·L−1 , NO平衡转化率为50%,则平衡常数K>2000
A、反应2NO(g)+O2(g)=2NO2(g)的ΔH>0 B、图中X点所示条件下,延长反应时间能提高NO转化率 C、图中Y点所示条件下,增加O2的浓度不能提高NO转化率 D、380℃下,c起始(O2)=5.0×10−4 mol·L−1 , NO平衡转化率为50%,则平衡常数K>2000三、实验探究题
-
3. 环戊二烯(
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)、已知:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)、已知: (g) =
(g) =  (g)+H2(g) ΔH1=100.3 kJ·mol −1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol −1 ① H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1 ②
对于反应:
 (g)+ I2(g) =
(g)+ I2(g) =  (g)+2HI(g) ③ ΔH3=kJ·mol −1。(2)、某温度下,等物质的量的碘和环戊烯(
(g)+2HI(g) ③ ΔH3=kJ·mol −1。(2)、某温度下,等物质的量的碘和环戊烯( )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为 , 该反应的平衡常数Kp=Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为 , 该反应的平衡常数Kp=Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有(填标号)。 A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
(3)、环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。 A、T1>T2 B、a点的反应速率小于c点的反应速率 C、a点的正反应速率大于b点的逆反应速率 D、b点时二聚体的浓度为0.45 mol·L−1(4)、环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为
A、T1>T2 B、a点的反应速率小于c点的反应速率 C、a点的正反应速率大于b点的逆反应速率 D、b点时二聚体的浓度为0.45 mol·L−1(4)、环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。 

该电解池的阳极为 , 总反应为。电解制备需要在无水条件下进行,原因为。
4. 近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:(1)、Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
可知反应平衡常数K(300℃)K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0 , 根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是。
(2)、Deacon直接氧化法可按下列催化过程进行:CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+ O2(g)=CuO(s)+ Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH= kJ·mol-1。
(3)、在一定温度的条件下,进一步提高HCl的转化率的方法是。(写出2种)
(4)、在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
负极区发生的反应有(写反应方程式)。电路中转移1 mol电子,需消耗氧气L(标准状况)
四、综合题
-
5. 水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:(1)、Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是COH2(填“大于”或“小于”)。
(2)、721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。A、<0.25 B、0.25 C、0.25~0.50 D、0.50 E、>0.50(3)、我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。
标注。

可知水煤气变换的ΔH0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=eV,写出该步骤的化学方程式。
(4)、Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。
计算曲线a的反应在30~90 min内的平均速率 (a)=kPa·min−1。467 ℃时PH2和PCO随时间变化关系的曲线分别是、。489 ℃时PH2和PCO随时间变化关系的曲线分别是、。
6. N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。(1)、N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为。(2)、NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH−=2 +H2O
2NO2+2OH−= + +H2O
①下列措施能提高尾气中NO和NO2去除率的有(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是(填化学式);吸收后排放的尾气中含量较高的氮氧化物是(填化学式)。
(3)、NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。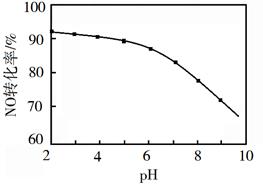
①在酸性NaClO溶液中,HClO氧化NO生成Cl−和 ,其离子方程式为。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是。
-
-