人教版化学高二选修2第一单元课题2人工固氮技术——合成氨同步练习
试卷更新日期:2015-12-09 类型:同步测试
一、选择题
-
1.
下面是合成氨的简要流程示意图,沿X线路回去的是( )
 A、N2和H2 B、催化剂 C、仅N2 D、仅H22. 下列关于催化剂的说法,正确的是( )
A、N2和H2 B、催化剂 C、仅N2 D、仅H22. 下列关于催化剂的说法,正确的是( )
A、催化剂能使不起反应的物质发生反应 B、在化学反应前后催化剂性质不改变,质量发生改变 C、催化剂能改变化学反应速率 D、在化学反应过程中,催化剂质量和化学性质都改变3.对于可逆反应N2(g)+3H2(g)
 2NH3(g) ΔH<0,下列说法正确的是( )A、达到平衡时反应物和生成物浓度一定相等 B、恒温恒压时达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时减小 C、达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以反应向逆反应的方向移动 D、加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率4. 关于氨的合成工业的下列说法正确的是( )A、从合成塔出来的气体,其中氨气一般占15%,所以生产氨的工业的效率都很低 B、由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高 C、合成氨工业的反应温度控制在400~500 ℃左右,目的是使平衡向正反应方向进行 D、合成氨工业采用10 MPa~30 MPa,是因该条件下催化剂的活性最好5. 为了进一步提高合成氨的生产效率,科研中具有研发价值的是( )A、研制高温下活性较大的催化剂 B、寻找NH3的新来源 C、研制低温下活性较大的催化剂 D、研制耐高温高压的新型生产设备6.
2NH3(g) ΔH<0,下列说法正确的是( )A、达到平衡时反应物和生成物浓度一定相等 B、恒温恒压时达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时减小 C、达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以反应向逆反应的方向移动 D、加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率4. 关于氨的合成工业的下列说法正确的是( )A、从合成塔出来的气体,其中氨气一般占15%,所以生产氨的工业的效率都很低 B、由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高 C、合成氨工业的反应温度控制在400~500 ℃左右,目的是使平衡向正反应方向进行 D、合成氨工业采用10 MPa~30 MPa,是因该条件下催化剂的活性最好5. 为了进一步提高合成氨的生产效率,科研中具有研发价值的是( )A、研制高温下活性较大的催化剂 B、寻找NH3的新来源 C、研制低温下活性较大的催化剂 D、研制耐高温高压的新型生产设备6.实验室合成氨装置如下图所示,则以下说法中错误的是( )
 A、装置甲的作用之一是干燥 B、装置甲的作用是化合 C、乙处导出的气体是N2、H2、NH3 D、检验产物可用湿润的红色石蕊试纸或浓盐酸等7. 下列有关合成氨工业的叙述,可用勒夏特列原理来解释的是( )A、使用铁触媒,使N2和H2混合气体有利于合成氨 B、高压比常压条件更有利于合成氨的反应 C、500 ℃左右比室温更有利于合成氨的反应 D、合成氨时采用循环操作,可提高原料的利用率8. 化工生产中,为加快反应速率应优先考虑的措施是( )A、选用适宜的催化剂 B、采用高压 C、采用高温 D、增大反应物浓度9. 某温度时,在一体积为2 L的密闭容器中,通入112 g N2和24 g的H2 , 此时容器内压强为p大气压。在该温度和催化剂作用下,H2和N2反应达到平衡,测得平衡时压强为0.95p大气压,下列说法不正确的是( )A、平衡时,N2物质的量是3.6 mol B、平衡时,H2的物质的量是10.8 mol C、平衡时,N2的转化率10% D、NH3的体积百分含量是10%10.
A、装置甲的作用之一是干燥 B、装置甲的作用是化合 C、乙处导出的气体是N2、H2、NH3 D、检验产物可用湿润的红色石蕊试纸或浓盐酸等7. 下列有关合成氨工业的叙述,可用勒夏特列原理来解释的是( )A、使用铁触媒,使N2和H2混合气体有利于合成氨 B、高压比常压条件更有利于合成氨的反应 C、500 ℃左右比室温更有利于合成氨的反应 D、合成氨时采用循环操作,可提高原料的利用率8. 化工生产中,为加快反应速率应优先考虑的措施是( )A、选用适宜的催化剂 B、采用高压 C、采用高温 D、增大反应物浓度9. 某温度时,在一体积为2 L的密闭容器中,通入112 g N2和24 g的H2 , 此时容器内压强为p大气压。在该温度和催化剂作用下,H2和N2反应达到平衡,测得平衡时压强为0.95p大气压,下列说法不正确的是( )A、平衡时,N2物质的量是3.6 mol B、平衡时,H2的物质的量是10.8 mol C、平衡时,N2的转化率10% D、NH3的体积百分含量是10%10.合成氨所用的H2可由煤与水反应制得,其中有一步反应为CO(g)+H2O(g)
 CO2(g)+H2(g),ΔH<0,欲提高CO转化率可采用的方法有:①降低温度;②增加压强;③使用催化剂;④增大CO的浓度;⑤增大水蒸气的浓度,其中正确的组合是( )A、①②③④⑤ B、①⑤ C、①④⑤ D、只有⑤11. 合成氨所需的原料是( )
CO2(g)+H2(g),ΔH<0,欲提高CO转化率可采用的方法有:①降低温度;②增加压强;③使用催化剂;④增大CO的浓度;⑤增大水蒸气的浓度,其中正确的组合是( )A、①②③④⑤ B、①⑤ C、①④⑤ D、只有⑤11. 合成氨所需的原料是( )①水 ②空气 ③焦炭 ④铁触媒
A、①② B、②③ C、①②③ D、全部12. 合成氨工业中控制的反应条件应( )
A、温度越高越好 B、压强越大越好 C、混合气体中氢气含量越高越好 D、所选的催化剂活性越大越好13. 为了进一步提高合成氨的生产效率,科研中具有开发价值的是( )A、研制高温下活性较大的催化剂 B、寻求NH3的新来源 C、研制低温下活性较大的催化剂 D、研制耐高温高压的新型材料建造合成塔14.反应C(s)+H2O(g)
 CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A、①④ B、②③ C、①③ D、②④15.对于可逆反应N2(气)+3H2(气)
 2NH3(气) ΔH<0,下列说法正确的是( )A、达到平衡时反应物和生成物浓度一定相等 B、达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时大 C、达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以平衡向逆反应的方向移动 D、加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率16.
2NH3(气) ΔH<0,下列说法正确的是( )A、达到平衡时反应物和生成物浓度一定相等 B、达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时大 C、达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以平衡向逆反应的方向移动 D、加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率16.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)
 2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )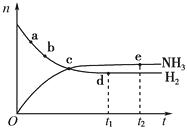 A、点a的正反应速率比点b的小 B、点c处反应达到平衡 C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 D、其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大17. 合成氨工业上采用循环操作,主要是为了( )A、加快反应速率 B、提高NH3的平衡浓度 C、降低NH3的沸点 D、提高N2和H2的利用率18. 工业合成氨的反应是在500 ℃左右进行,主要原因是( )A、500 ℃时反应速率最快 B、500 ℃时的平衡浓度最大 C、500 ℃时的转化率最高 D、500 ℃催化剂能发挥最大效力19.
A、点a的正反应速率比点b的小 B、点c处反应达到平衡 C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 D、其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大17. 合成氨工业上采用循环操作,主要是为了( )A、加快反应速率 B、提高NH3的平衡浓度 C、降低NH3的沸点 D、提高N2和H2的利用率18. 工业合成氨的反应是在500 ℃左右进行,主要原因是( )A、500 ℃时反应速率最快 B、500 ℃时的平衡浓度最大 C、500 ℃时的转化率最高 D、500 ℃催化剂能发挥最大效力19.将空气中氮气转化为氮的化合物的过程称为固氮,下图中能实现人工固氮的是( )
 A、A B、B C、C D、D20. 在一定条件下,进入氨合成塔的混合气体中氮气的体积占22%,氢气的体积占78%,经合成反应达到平衡后,在相同温度和压强下,气体体积缩小至原体积的95%,氮气的转化率接近于( )A、11.5% B、10.5% C、9.75% D、13.2%
A、A B、B C、C D、D20. 在一定条件下,进入氨合成塔的混合气体中氮气的体积占22%,氢气的体积占78%,经合成反应达到平衡后,在相同温度和压强下,气体体积缩小至原体积的95%,氮气的转化率接近于( )A、11.5% B、10.5% C、9.75% D、13.2%二、非选择题
-
21.
合成氨工业中,原料气(N2、H2及CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(l)溶液来吸收原料中的CO,其反应是
[Cu(NH3)2Ac]+CO+NH3
 [Cu(NH3)3]Ac·CO+Q(1)、必须除去原料气中CO的原因是?(2)、醋酸二氨合铜(l)吸收CO的适宜条件是。(3)、吸收CO后的醋酸铜氨液经过适当处理又可再生,恢复其吸收CO的能力以循环使用,醋酸铜氨液再生的适宜条件是。22. 在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
[Cu(NH3)3]Ac·CO+Q(1)、必须除去原料气中CO的原因是?(2)、醋酸二氨合铜(l)吸收CO的适宜条件是。(3)、吸收CO后的醋酸铜氨液经过适当处理又可再生,恢复其吸收CO的能力以循环使用,醋酸铜氨液再生的适宜条件是。22. 在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:①C+H2O(g) CO+H2;
②CO+H2O(g) CO2+H2;
(1)、已知CO(g)+1/2O2(g)=CO2(g);ΔH=-283.0 kJ/mol;H2(g)+1/2 O2(g)=H2O(g);ΔH=-285.8 kJ/mol;写出上述CO与H2O(g)反应的热化学方程式:
(2)、从反应混合物中分离出H2的方法通常是以碱液洗气,根据该工业生产的实际分析,最好选用下列哪种溶液作为吸收剂? , 理由是。A.氢氧化钠溶液
B.氨水
C.石灰水或石灰乳
(3)、在实验室模拟上述反应②,830 ℃时在1 L的容器中装入CO和H2O(g)各2 mol使之反应,达到平衡时测得容器中CO2的浓度为1 mol/L,计算830 ℃时该反应的平衡常数。23.已知:N2(g)+3H2(g)
 2NH3(g)(正反应为放热反应),2SO2(g)+O2(g)
2NH3(g)(正反应为放热反应),2SO2(g)+O2(g) 2SO3(g)(正反应为放热反应)。
2SO3(g)(正反应为放热反应)。请回答下列问题:
(1)、从影响化学反应速率和化学平衡的因素分析,要有利于NH3和SO3的生成,理论上应采取的措施是。实际生产中采取的措施是、 。
(2)、在合成氨的工业生产中,要分离出氨,目的是;而合成SO3的过程中,则不需要分离出SO3 , 原因是。24.某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图。
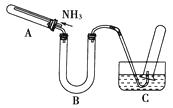
材料一 NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物。如:2NH3+3CuO
 3Cu+N2+3H2O;
3Cu+N2+3H2O;材料二 Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu,Cu2O+2H+=Cu2++Cu+H2O。
请回答下列问题:
(1)、在实验室里,该学习小组设计下列制取纯净干燥氨气的方案,简易、可行的最佳方案是________。A、加热氯化铵固体,再通过碱石灰 B、在N2和H2的混合气体中加入铁触媒,并加热至500 ℃,再通过碱石灰 C、加热浓氨水,再通过碱石灰 D、在生石灰中加入浓氨水,再通过碱石灰(2)、为证明NH3还原CuO的反应中有水生成,B中应放入的试剂是。(3)、当观察到(填现象),即表明A中的反应已经完成。(4)、该小组欲用体积比为1∶4的稀硫酸作试剂,检验反应是否有Cu2O固体生成。现用98%的浓硫酸配制1∶4的稀硫酸,所需的玻璃仪器除了胶头滴管外还有。可证明还原产物中含有Cu2O的操作及现象是。
(5)、请写出A中生成Cu2O的化学方程式。(6)、若用定量的方法测定该反应是否生成Cu2O,最简便且准确的方法是。25.实验室模拟合成氨和氨催化氧化的流程如下:
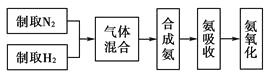
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
 (1)、从上图中选择制取气体的合适装置:氮气、氢气。(2)、
(1)、从上图中选择制取气体的合适装置:氮气、氢气。(2)、氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有、。
 (3)、氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,(“会”或“不会”)发生倒吸;原因是。(4)、用乙装置吸收一段时间氨后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是 ,
(3)、氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,(“会”或“不会”)发生倒吸;原因是。(4)、用乙装置吸收一段时间氨后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是 ,锥形瓶中还可观察到的现象是。
(5)、写出乙装置中氨氧化的化学方程式:。(6)、反应结束后锥形瓶内的溶液中含有H+、OH-、、。