福建省南平市2017-2018学年高一下学期化学期末考试试卷
试卷更新日期:2019-06-11 类型:期末考试
一、单选题
-
1. 据报道, 可有效地治疗肝癌,下列关于 说法正确的是( )A、中子数为166 B、质量数为223 C、质子数为67 D、核外电子数为992. 下图是元素周期表的部分,下列说法错误的是( )
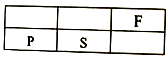 A、元素最高化合价:F>S>P B、酸性强弱:H2SO4>H3PO4 C、非金属性F>S>P D、最外层电子数:F>S>P3. 短周期主族元素X、Y、Z的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z的核电荷数比Y多4。下列说法正确的是( )A、原子半径的大小顺序:Z>Y>X B、Y分别与Z、X形成的化合物中化学键类型相同 C、单质Z能在X的最高价氧化物中燃烧 D、Y、X的简单气态氢化物的热稳定性:Y<X4. 分析图中的信息,下列说法错误的是( )
A、元素最高化合价:F>S>P B、酸性强弱:H2SO4>H3PO4 C、非金属性F>S>P D、最外层电子数:F>S>P3. 短周期主族元素X、Y、Z的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z的核电荷数比Y多4。下列说法正确的是( )A、原子半径的大小顺序:Z>Y>X B、Y分别与Z、X形成的化合物中化学键类型相同 C、单质Z能在X的最高价氧化物中燃烧 D、Y、X的简单气态氢化物的热稳定性:Y<X4. 分析图中的信息,下列说法错误的是( )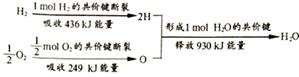 A、1molH2和1/2molO2参加反应,结果放出930kJ的热量 B、破坏旧化学键,需要吸收一定的能量来克服原子间的相互作用力 C、该反应中断键所吸收的能量比成键所放出的能量少 D、该反应中,H2、02分子分裂为H、O原子,H、O原子重新组合成水分子5. 一定条件下,密闭容器中的反应N2+3H2 2NH3 , 达到化学平衡状态的标志是( )A、单位时间内消耗1 mol N2 , 同时生成2 mol NH3 B、容器内三种气体物质的量比为n(N2):n(H2):n(NH3)=1:3:2 C、断裂1molH-H键同时生成2molN-H键 D、容器中各组分的物质的量分数不随时间变化6. 将相同的锌片和铜片按图示方式插入同浓度的稀硫酸中,以下叙述正确的是( )
A、1molH2和1/2molO2参加反应,结果放出930kJ的热量 B、破坏旧化学键,需要吸收一定的能量来克服原子间的相互作用力 C、该反应中断键所吸收的能量比成键所放出的能量少 D、该反应中,H2、02分子分裂为H、O原子,H、O原子重新组合成水分子5. 一定条件下,密闭容器中的反应N2+3H2 2NH3 , 达到化学平衡状态的标志是( )A、单位时间内消耗1 mol N2 , 同时生成2 mol NH3 B、容器内三种气体物质的量比为n(N2):n(H2):n(NH3)=1:3:2 C、断裂1molH-H键同时生成2molN-H键 D、容器中各组分的物质的量分数不随时间变化6. 将相同的锌片和铜片按图示方式插入同浓度的稀硫酸中,以下叙述正确的是( ) A、两烧杯中铜片表面均无气泡产生 B、两烧杯中溶液的H+浓度都减小 C、产生气泡的速率甲比乙慢 D、甲中铜片是正极,乙中铜片是负极7. 下列说法正确的是( )A、有机物都可以燃烧生成CO2和H2O B、石油与氯仿都有固定的熔、沸点 C、甲烷和氯气可以发生置换反应 D、丙烷的一氯代物有两种8. 有机物CH2=CHCH2OH不能发生的反应是( )A、加成反应 B、中和反应 C、氧化反应 D、取代反应9. 糖类、油脂和蛋白质是维持人体生命活动必需的三大营养物质。下列说法正确的是( )A、所有的糖类在一定条件下均能发生水解反应 B、淀粉和纤维素互为同分异构体 C、蛋白质溶液中加入硫酸铜溶液后产生的沉淀不能重新溶于水 D、油脂发生皂化反应生成甘油和高级脂肪酸10. 下列说法正确的是( )A、乙烯通过聚合反应可得到高分子材料 B、聚丙烯的结构单元是—CH2-CH2-CH2— C、碳纤维属于合成有机高分子化合物 D、聚乙烯塑料的老化是因为发生了加成反应11. 下列图表中a、
A、两烧杯中铜片表面均无气泡产生 B、两烧杯中溶液的H+浓度都减小 C、产生气泡的速率甲比乙慢 D、甲中铜片是正极,乙中铜片是负极7. 下列说法正确的是( )A、有机物都可以燃烧生成CO2和H2O B、石油与氯仿都有固定的熔、沸点 C、甲烷和氯气可以发生置换反应 D、丙烷的一氯代物有两种8. 有机物CH2=CHCH2OH不能发生的反应是( )A、加成反应 B、中和反应 C、氧化反应 D、取代反应9. 糖类、油脂和蛋白质是维持人体生命活动必需的三大营养物质。下列说法正确的是( )A、所有的糖类在一定条件下均能发生水解反应 B、淀粉和纤维素互为同分异构体 C、蛋白质溶液中加入硫酸铜溶液后产生的沉淀不能重新溶于水 D、油脂发生皂化反应生成甘油和高级脂肪酸10. 下列说法正确的是( )A、乙烯通过聚合反应可得到高分子材料 B、聚丙烯的结构单元是—CH2-CH2-CH2— C、碳纤维属于合成有机高分子化合物 D、聚乙烯塑料的老化是因为发生了加成反应11. 下列图表中a、B、c表示对应装置的仪器中加入的试剂,可制取、净化、收集的气体是( )
选项
a
b
c
气体
装置
A
浓氨水
生石灰
浓硫酸
NH3

B
浓H2SO4
铜屑
NaOH溶液
SO2
C
稀HNO3
铜屑
H2O
NO
D
稀盐酸
碳酸钙
饱和NaHCO3溶液
CO2
A、A B、B C、C D、D12. S2Cl2分子结构如图所示。常温下,S2Cl2遇水易水解并产生能使品红褪色的气体。下列说法错误的是( )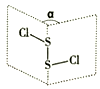 A、S2Cl2分子中所有原子不在同一平面 B、13.5 gS2Cl2中共价键的数目为0.4NA C、S2Cl2与水反应时S-S、S-Cl键都断裂 D、S2Cl2中S-S键和S-Cl键是共价键13. 下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是( )
A、S2Cl2分子中所有原子不在同一平面 B、13.5 gS2Cl2中共价键的数目为0.4NA C、S2Cl2与水反应时S-S、S-Cl键都断裂 D、S2Cl2中S-S键和S-Cl键是共价键13. 下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是( ) A、Z、N两种元素的离子半径相比,前者大 B、X、N两种元素的氢化物的沸点相比,前者较低 C、M比X的原子序数多7 D、Z单质均能溶解于Y的氢氧化物和N的氢化物的水溶液中14. 工业上电解食盐水的原理是:2NaCl+2H2O 2NaOH+H2↑+Cl2↑。成品碱中含有氯化钠杂质,可通过分光光度法测定每克成品碱中氯化钠的含量,其测量值(吸光度A)与每克成品碱中氯化钠含量的关系如下图,氯化钠杂质小于0.0050%的成品碱为优品级。下列说法错误的是( )
A、Z、N两种元素的离子半径相比,前者大 B、X、N两种元素的氢化物的沸点相比,前者较低 C、M比X的原子序数多7 D、Z单质均能溶解于Y的氢氧化物和N的氢化物的水溶液中14. 工业上电解食盐水的原理是:2NaCl+2H2O 2NaOH+H2↑+Cl2↑。成品碱中含有氯化钠杂质,可通过分光光度法测定每克成品碱中氯化钠的含量,其测量值(吸光度A)与每克成品碱中氯化钠含量的关系如下图,氯化钠杂质小于0.0050%的成品碱为优品级。下列说法错误的是( )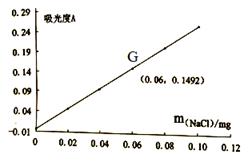 A、吸光度A的值越大,样品中氯化钠含量越小 B、分光光度法是对物质组成进行定性和定量的测定 C、图中G点所测的成品碱不是优品级 D、成品碱是否含有NaCl,可用硝酸酸化的硝酸银溶液检验
A、吸光度A的值越大,样品中氯化钠含量越小 B、分光光度法是对物质组成进行定性和定量的测定 C、图中G点所测的成品碱不是优品级 D、成品碱是否含有NaCl,可用硝酸酸化的硝酸银溶液检验二、填空题
-
15. 位于3个不同短周期的主族元素a、b、c、d、e,原子序数依次增大,其中b、d同主族,d元素最高化合价与最低化合价代数和等于4,c原子最外层电子数比b原子次外层电子数多1,回答下列问题。(1)、写出a的元素符号 , b在周期表中的位置是第周期族;(2)、a与e形成的是(填“离子”或“共价”)化合物;(3)、上述五种元素中,非金属性最强的是(填元素名称);(4)、d元素最高价氧化物对应水化物的化学式是 , d和e的气态氢化物稳定性强的是(填化学式);(5)、元素c的原子结构示意图为;c的单质与a的同主族第3周期元素最高价氧化物对应水化物反应的离子方程式为。16. 下图甲~丁是四种有机物分子的球棍模型。
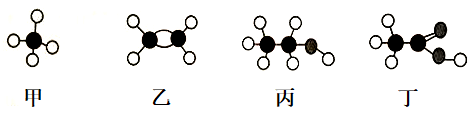 (1)、甲分子的空间构型是 , 乙的电子式为。(2)、丙与丁反应的化学方程式。
(1)、甲分子的空间构型是 , 乙的电子式为。(2)、丙与丁反应的化学方程式。下图是用燃烧法来确定有机物组成的常用装置。其方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量来确定有机物的组成。
已知:装置C中的氧化铜是确保有机物中的碳元素完全转化为二氧化碳,A中的反应为2H2O2 2H2O+O2↑。
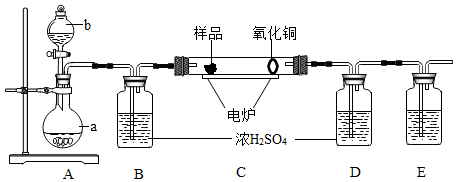 (3)、A装置中b仪器的名称 , 盛放的物质是(填化学式)。(4)、若无B装置会对元素的测量结果有影响(填元素符号)。(5)、E装置中所盛放物质最好选用(选填:①氢氧化钙溶液;②氢氧化钠溶液;③水)。(6)、若准确称取1.12g样品(样品只含C、H、O三种元素中的两种或三种)。经充分燃烧后继续通入氧气一会儿,冷却,称量,D装置增重1.44g,E装置增重3.52g,则该有机物样品中所含的元素为(填元素符号)。
(3)、A装置中b仪器的名称 , 盛放的物质是(填化学式)。(4)、若无B装置会对元素的测量结果有影响(填元素符号)。(5)、E装置中所盛放物质最好选用(选填:①氢氧化钙溶液;②氢氧化钠溶液;③水)。(6)、若准确称取1.12g样品(样品只含C、H、O三种元素中的两种或三种)。经充分燃烧后继续通入氧气一会儿,冷却,称量,D装置增重1.44g,E装置增重3.52g,则该有机物样品中所含的元素为(填元素符号)。三、实验题
-
17. 某实验小组通过铁与盐酸反应的实验,研究影响反应速率的因素(铁的质量相等,铁块的形状一样,盐酸均过量),设计实验如下表:
实验编号
盐酸浓度/(mol/L)
铁的形态
温度/K
①
4.00
块状
293
②
4.00
粉末
293
③
2.00
块状
293
④
2.00
粉末
313
(1)、若四组实验均反应进行1分钟(铁有剩余),则以上实验需要测出的数据是。(2)、实验和(填实验编号)是研究盐酸的浓度对该反应速率的影响;实验1和2是研究对该反应速率的影响。(3)、测定在不同时间产生氢气体积V的数据,绘制出图甲,则曲线c、d分别对应的实验组别可能是、。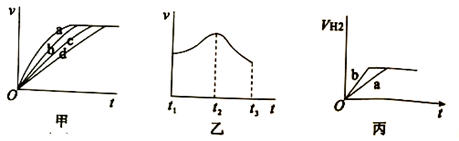 (4)、分析其中一组实验,发现产生氢气的速率随时间变化情况如图乙所示。
(4)、分析其中一组实验,发现产生氢气的速率随时间变化情况如图乙所示。①其中t1~t2速率变化的主要原因是。
②t2~t3速率变化的主要原因是 。
(5)、实验1产生氢气的体积如丙中的曲线a,添加某试剂能使曲线a变为曲线b的是______。A、CuO粉末 B、NaNO3固体 C、NaCl溶液 D、浓H2SO418. 除去工业尾气中的氮氧化合物(如NO),常用氨催化吸收法,原理是NH3与NO按一定比例反应生成无毒物质。某同学在实验室里采用以下装置和步骤模拟工业上对NO的处理。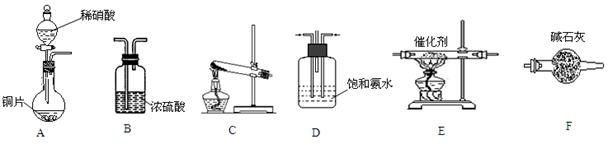 (1)、装置A的反应中,还原产物是。(2)、若选择装置C制取氨气,则反应的化学方程式是。
(1)、装置A的反应中,还原产物是。(2)、若选择装置C制取氨气,则反应的化学方程式是。
(3)、选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
在括号中填入选用的装置编号: 。、
。、
(4)、装置D的一种作用是。(5)、装置B的作用是______(填序号)。A、吸收氮氧化物 B、吸收氨气 C、干燥反应的混合气体(6)、装置E中发生反应的化学方程式为。19. 无水AlCl3是一种重要的化工原料。某课外活动小组尝试制取无水AlCl3并进行相关探究。资料信息:无水AlCl3在178℃升华,极易潮解,遇到潮湿空气会产生白色烟雾。
(1)、(探究一)无水AlCl3的实验室制备利用下图装置,用干燥、纯净的氯气在加热条件下与纯铝粉反应制取无水AlCl3。供选择的药品:①铝粉②浓硫酸③稀盐酸④饱和食盐水⑤二氧化锰粉末⑥无水氯化钙⑦稀硫酸⑧浓盐酸⑨氢氧化钠溶液。

写出装置A发生的反应方程式。
(2)、装置E需用到上述供选药品中的(填数字序号),装置F的作用是。(3)、写出无水AlCl3遇到潮湿空气发生反应的化学方程式。(4)、(探究二)离子浓度对氯气制备的影响探究二氧化锰粉末和浓盐酸的反应随着盐酸的浓度降低,反应会停止的原因:
提出假设:假设1.Cl-浓度降低影响氯气的生成;假设2.。
(5)、设计实验方案:(限选试剂:浓H2SO4、NaCl固体、MnO2固体、稀盐酸)步骤
实验操作
预测现象和结论
①
往不再产生氯气的装置中,加入继续加热
若有黄绿色气体生成,则假设1成立
②
若有黄绿色气体生成,则假设2成立
(6)、(探究三)无水AlCl3的含量测定及结果分析取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如下:
第一次实验
第二次实验
第三次实验
D中固体用量
2.0g
2.0g
2.0g
氢气的体积
334.5mL
336.0mL
337.5mL
根据表中数据,计算所得固体中无水AlCl3的质量分数。
(7)、有人认为D中制得无水AlCl3的质量分数偏低,可能的一种原因是。