北京市朝阳区2017-2018学年高二下学期化学期末考试试卷
试卷更新日期:2019-06-11 类型:期末考试
一、单选题
-
1. 下列物质属于弱电解质的是( )A、NaCl B、NaOH C、CH3COOH D、CO22. 下列反应中,属于吸热反应的是()A、Al与盐酸反应 B、盐酸和NaOH溶液反应 C、乙醇燃烧反应 D、Ba(OH)2·8H2O晶体与NH4Cl固体反应3. 常温下,最适宜薄荷生长的土壤pH≈8,土壤中的c(OH-)最接近于()A、1×10-5mol/L B、1×10-6 mol/L C、1×10-8 mol/L D、1×10-9mol/L4. 下列装置工作时,将化学能转化为电能的是()
A
B
C
D
燃气灶
硅太阳能电池
碱性锌锰电池
风力发电机



 A、A B、B C、C D、D5. 下列措施不能加快Zn与1mol/LH2SO4反应产生H2的速率的是()A、升高温度 B、用Zn粉代替Zn粒 C、改用0.1mol/LH2SO4与Zn反应 D、滴加少量的CuSO4溶液6. 下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质的是()A、FeSO4 B、MgSO4 C、AlCl3 D、NH4Cl7. 下列事实中,使用牺牲阳极的阴极保护法进行金属防腐的是()A、地下钢管连接镁块 B、金属护栏表面涂漆 C、汽车底盘喷涂高分子膜 D、水中的钢闸门连接电源的负极8. 200℃、101kPa时,在密闭容器中充入1molH2和1molI2 , 发生反应I2(g)+H2(g) 2HI(g) ΔH=-14.9kJ/mol。反应一段时间后,能说明反应已经达到化学平衡状态的是()A、放出的热量小于14.9kJ B、反应容器内压强不再变化 C、HI生成的速率与HI分解的速率相等 D、单位时间内消耗a molH2 , 同时生成2amolHI9. 下列解释事实的反应方程式错误的是()A、碳酸钠溶液显碱性:CO32-+H2O HCO3-+OH- B、钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ C、以Na2S为沉淀剂,除去溶液中的Cu2+:Cu2++S2-=CuS↓ D、向KI溶液中滴加稀硫酸和淀粉溶液,放置在空气中变蓝:4H++4I-+O2=2I2+2H2O10. 常温下,下列关于NaOH溶液和氨水的说法正确的是()A、相同物质的量浓度的两溶液中的c(OH-)相等 B、pH=13的两溶液稀释100倍,pH都为11 C、两溶液中分别加入少量NH4Cl固体,c(OH-)均减小 D、体积相同、pH相同的两溶液能中和等物质的量的盐酸11. 对可逆反应 ,下列图象正确的是()A、
A、A B、B C、C D、D5. 下列措施不能加快Zn与1mol/LH2SO4反应产生H2的速率的是()A、升高温度 B、用Zn粉代替Zn粒 C、改用0.1mol/LH2SO4与Zn反应 D、滴加少量的CuSO4溶液6. 下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质的是()A、FeSO4 B、MgSO4 C、AlCl3 D、NH4Cl7. 下列事实中,使用牺牲阳极的阴极保护法进行金属防腐的是()A、地下钢管连接镁块 B、金属护栏表面涂漆 C、汽车底盘喷涂高分子膜 D、水中的钢闸门连接电源的负极8. 200℃、101kPa时,在密闭容器中充入1molH2和1molI2 , 发生反应I2(g)+H2(g) 2HI(g) ΔH=-14.9kJ/mol。反应一段时间后,能说明反应已经达到化学平衡状态的是()A、放出的热量小于14.9kJ B、反应容器内压强不再变化 C、HI生成的速率与HI分解的速率相等 D、单位时间内消耗a molH2 , 同时生成2amolHI9. 下列解释事实的反应方程式错误的是()A、碳酸钠溶液显碱性:CO32-+H2O HCO3-+OH- B、钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ C、以Na2S为沉淀剂,除去溶液中的Cu2+:Cu2++S2-=CuS↓ D、向KI溶液中滴加稀硫酸和淀粉溶液,放置在空气中变蓝:4H++4I-+O2=2I2+2H2O10. 常温下,下列关于NaOH溶液和氨水的说法正确的是()A、相同物质的量浓度的两溶液中的c(OH-)相等 B、pH=13的两溶液稀释100倍,pH都为11 C、两溶液中分别加入少量NH4Cl固体,c(OH-)均减小 D、体积相同、pH相同的两溶液能中和等物质的量的盐酸11. 对可逆反应 ,下列图象正确的是()A、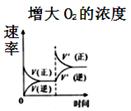 B、
B、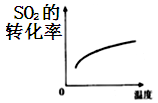 C、
C、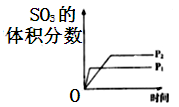 D、
D、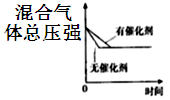 12. 醋酸的电离方程式为CH3COOH(aq) H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka= =1.75×10-5 , 其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是()A、向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小 B、向该溶液中加少量CH3COONa固体,平衡正向移动 C、该温度下0.01mol/L醋酸溶液Ka<1.75×10-5 D、升高温度,c(H+)增大,Ka变大13. 下列关于0.1mol/LNaHCO3溶液中微粒浓度的关系式正确的是()A、c(CO32-)>c(H2CO3) B、c(Na+)>c(HCO3-)>c(OH-)>c(H+) C、c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)] D、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)14. 下列用来解释实验事实的相关平衡方程式错误的是()
12. 醋酸的电离方程式为CH3COOH(aq) H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka= =1.75×10-5 , 其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是()A、向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小 B、向该溶液中加少量CH3COONa固体,平衡正向移动 C、该温度下0.01mol/L醋酸溶液Ka<1.75×10-5 D、升高温度,c(H+)增大,Ka变大13. 下列关于0.1mol/LNaHCO3溶液中微粒浓度的关系式正确的是()A、c(CO32-)>c(H2CO3) B、c(Na+)>c(HCO3-)>c(OH-)>c(H+) C、c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)] D、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)14. 下列用来解释实验事实的相关平衡方程式错误的是()实验事实
相关平衡
A
加入NaHCO3使氯水的漂白能力增强
Cl2+H2O HClO+HCl
B
配制FeCl3溶液时加少量盐酸
Fe3++3OH- Fe(OH)3
C
溶有CO2的正常雨水pH≈5.6
H2O+CO2 H2CO3 H++HCO3-
D
CaCO3固体溶于盐酸
CaCO3(s) Ca2+(aq)+CO32-(aq)
A、A B、B C、C D、D15. 一定温度下,10mL0.4mol/LH2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表:t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述错误的是(溶液体积变化忽略不计)()
A、0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min) B、6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·min) C、反应至6min时,c(H2O2)=0.20mol/L D、反应至6min时,H2O2分解了40%16. 下图为H2与O2反应生成H2O(g)的能量变化示意图,下列有关叙述错误的是() A、1molH2分子断键需要吸收436kJ的能量 B、H2(g)+ O2(g)=H2O(g) ΔH=-241.8kJ/mol C、反应物的总能量高于生成物的总能量 D、形成化学键释放的总能量比断裂化学键吸收的总能量小17. 用石墨作电极,电解盛放在U形管中的饱和NaCl溶液(滴有酚酞溶液),如图。下列叙述正确的是()
A、1molH2分子断键需要吸收436kJ的能量 B、H2(g)+ O2(g)=H2O(g) ΔH=-241.8kJ/mol C、反应物的总能量高于生成物的总能量 D、形成化学键释放的总能量比断裂化学键吸收的总能量小17. 用石墨作电极,电解盛放在U形管中的饱和NaCl溶液(滴有酚酞溶液),如图。下列叙述正确的是() A、通电后,NaCl发生电离 B、通电一段时间后,阳极附近溶液先变红 C、当阳极生成0.1 mol气体时,整个电路中转移了0.1mole- D、电解饱和食盐水的总反应式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑18. 实验:①0.1mol/LAgNO3溶液和0.1mol/LNaCl溶液等体积混合得到浊液,过滤.
A、通电后,NaCl发生电离 B、通电一段时间后,阳极附近溶液先变红 C、当阳极生成0.1 mol气体时,整个电路中转移了0.1mole- D、电解饱和食盐水的总反应式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑18. 实验:①0.1mol/LAgNO3溶液和0.1mol/LNaCl溶液等体积混合得到浊液,过滤.②取等量①的滤液于两支试管中,分别滴加等浓度等体积的Na2S溶液、Na2SO4溶液,前者出现浑浊,后者溶液仍澄清.
③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解.
下列分析错误的是()
A、①中生成AgCl沉淀,溶液中c(Ag+)和c(Cl﹣)大量减少 B、①的滤液中不含有Ag+ C、②的现象说明该温度下Ag2S比Ag2SO4更难溶 D、③中生成Ag(NH3)2+ , 使c(Ag+)减小,促进AgCl(s)溶解平衡正向移动19. 已知反应:2NO2(红棕色) N2O4(无色),分别进行如下两个实验:
N2O4(无色),分别进行如下两个实验: 实验ⅰ:将NO2球分别浸泡在热水和冰水中,现象如图1。
实验ⅱ:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),如图2。下列说法错误的是()
图1
 图2
图2  A、图1现象说明该反应为放热反应 B、图2中b点的操作是压缩注射器 C、c点:v(正)>v(逆) D、若不忽略体系温度变化,且没有能量损失,则T(d)<T(c)20. 热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法错误的是()
A、图1现象说明该反应为放热反应 B、图2中b点的操作是压缩注射器 C、c点:v(正)>v(逆) D、若不忽略体系温度变化,且没有能量损失,则T(d)<T(c)20. 热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法错误的是() A、放电时,电子由Ca电极流出 B、放电过程中,Li+向PbSO4电极移动 C、每转移0.2mol电子,理论上生成20.7gPb D、负极反应式:PbSO4+2e-+2Li+=Li2SO4+Pb
A、放电时,电子由Ca电极流出 B、放电过程中,Li+向PbSO4电极移动 C、每转移0.2mol电子,理论上生成20.7gPb D、负极反应式:PbSO4+2e-+2Li+=Li2SO4+Pb二、综合题
-
21.(1)、通过火法冶金炼出的铜是粗铜,含杂质多,必须进行电解精炼。请在下面方框中画出电解精炼铜的装置。
 (2)、水解反应在生产生活中有很多应用。有些盐水解程度很大,可以用于无机化合物的制备,如可以用TiCl4与H2O反应,生成TiO2·xH2O,制备时加入大量的水,同时加热。请结合化学用语和必要的文字解释“加热”的作用:。22. 卤块的主要成分是MgCl2 , 此外还含有Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
(2)、水解反应在生产生活中有很多应用。有些盐水解程度很大,可以用于无机化合物的制备,如可以用TiCl4与H2O反应,生成TiO2·xH2O,制备时加入大量的水,同时加热。请结合化学用语和必要的文字解释“加热”的作用:。22. 卤块的主要成分是MgCl2 , 此外还含有Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
已知1:生成氢氧化物沉淀的pH
物质
开始沉淀
沉淀完全
Fe(OH)2
7.6
9.6
Fe(OH)3
2.7
3.7
Mn(OH)2
8.3
9.8
Mg(OH)2
9.6
11.1
已知2:几种难溶电解质的溶解度(20℃)
物质
溶解度/g
Fe(OH)2
5.2×10-5
Fe(OH)3
3×10-9
MgCO3
3.9×10-2
Mg(OH)2
9×10-4
(已知:Fe2+氢氧化物呈絮状,不易从溶液中除去)
请回答:
(1)、步骤Ⅱ中加入的试剂X为漂液(含25.2%NaClO)。①用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色。说明漂液具有的性质是。
②用化学用语表示NaClO溶液使pH试纸变蓝的原因。
③步骤Ⅱ中漂液的主要作用是。
④若用H2O2代替漂液,发生反应的离子方程式为。
(2)、步骤Ⅲ中加入的试剂Y为NaOH,应将溶液的pH调节为 , 目的是。(3)、步骤Ⅳ中加入的试剂Z为Na2CO3 , 发生反应的离子方程式为。(4)、结合化学用语,应用化学平衡移动原理解释步骤Ⅴ中反应发生的原因。23. 氨是化学实验室及化工生产中的重要物质,应用广泛。(1)、已知25℃时:N2(g)+O2(g) 2NO(g) ΔH=+183kJ/mol2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=-1164.4kJ/mol
则N2(g)+3H2(g) 2NH3(g) ΔH=kJ/mol
(2)、在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:N2
H2
NH3
投料Ⅰ
1.0mol/L
3.0mol/L
0
投料Ⅱ
0.5mol/L
1.5mol/L
1.0mol/L
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为。
②按投料Ⅱ进行反应,起始时反应进行的方向为(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数(填“变大”、“变小”或“不变”)。
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

ⅰ.X代表的物理量是。
ⅱ.判断L1、L2的大小关系,并简述理由。
(3)、电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
①电极b上发生的是反应(填“氧化”或“还原”)。
②写出电极a的电极反应式。
三、实验题
-
24. 应用电化学原理,回答下列问题:
 (1)、上述三个装置中,负极反应物化学性质上的共同特点是。(2)、甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是。(3)、乙中正极反应式为;若将H2换成CH4 , 则负极反应式为。(4)、丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池极相连接。(5)、应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:
(1)、上述三个装置中,负极反应物化学性质上的共同特点是。(2)、甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是。(3)、乙中正极反应式为;若将H2换成CH4 , 则负极反应式为。(4)、丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池极相连接。(5)、应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:
ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U型管左侧逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①实验ⅰ中银作极。
②综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是。
25. 某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,实验数据如下:实验序号
①
②
③
加入试剂
0.01mol/LKMnO4
0.1mol/LH2C2O4
0.01mol/LKMnO4
0.1mol/LH2C2O4
MnSO4固体
0.01mol/LKMnO4
0.1mol/LH2C2O4
Na2SO4固体
褪色时间/s
116
6
117
请回答:
(1)、该实验结论是。(2)、还可以控制变量,研究哪些因素对该反应速率的影响。(3)、进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论。请你写出实验①的现象并分析产生该现象的原因。(4)、实验②选用MnSO4固体而不是MnCl2固体的原因是。四、填空题
-
26.(1)、室温下,使用pH计测定0.1 mol/LNH4Cl溶液的pH=5.12。由此可以得到的结论是(填字母)。
a.溶液中c(H+)>c(OH-)
b.NH4+水解是微弱的
c.NH3·H2O是弱碱
d.由H2O电离出的c(H+)<10-7mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)、室温下,用0.1mol/LNaOH溶液分别滴定20.00mL0.1mol/L的盐酸和醋酸,滴定曲线如图所示,
①表示滴定盐酸的曲线是(填序号)。
②滴定醋酸溶液的过程中:
ⅰ.V(NaOH)=10.00mL时,溶液中离子浓度由大到小的顺序为。
ⅱ.当c(Na+)=c(CH3COO-)+c(CH3COOH)时,溶液pH7(填“>”、“=”或“<”)。