2019年高考理综化学真题试卷(天津卷)
试卷更新日期:2019-06-09 类型:高考真卷
一、选择题
-
1. 化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是( )A、利用废弃的秸秆生产生物质燃料乙醇 B、利用石油生产塑料、化纤等高分子材料 C、利用基本的化学原料生产化学合成药物 D、利用反渗透膜从海水中分离出淡水2. 下列离子方程式能用来解释相应实验现象的是( )
实验现象
离子方程式
A
向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解
B
向沸水中滴加饱和氯化铁溶液得到红褐色液体
C
二氧化硫使酸性高锰酸钾溶液褪色
D
氧化亚铁溶于稀硝酸
A、A B、B C、C D、D3. 下列有关金属及其化合物的不合理的是( )A、将废铁屑加入 溶液中,可用于除去工业废气中的 B、铝中添加适量钾,制得低密度、高强度的铝合金,可用于航空工业 C、盐碱地(含较多 等)不利于作物生长,可施加熟石灰进行改良 D、无水 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水4. 下列实验操作或装置能达到目的的是( )A
B
C
D
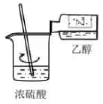
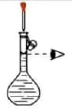
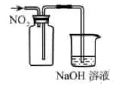
混合浓硫酸和乙醇
配制一定浓度的溶液
收集 气体
证明乙炔可使溴水褪色
A、A B、B C、C D、D5. 某温度下, 和 的电离常数分别为 和 。将 和体积均相同的两种酸溶液分别稀释,其 随加水体积的变化如图所示。下列叙述正确的是( ) A、曲线Ⅰ代表 溶液 B、溶液中水的电离程度:b点>c点 C、从c点到d点,溶液中 保持不变(其中 、 分别代表相应的酸和酸根离子) D、相同体积a点的两溶液分别与 恰好中和后,溶液中 相同6. 我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。
A、曲线Ⅰ代表 溶液 B、溶液中水的电离程度:b点>c点 C、从c点到d点,溶液中 保持不变(其中 、 分别代表相应的酸和酸根离子) D、相同体积a点的两溶液分别与 恰好中和后,溶液中 相同6. 我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。 A、放电时,a电极反应为 B、放电时,溶液中离子的数目增大 C、充电时,b电极每增重 ,溶液中有 被氧化 D、充电时,a电极接外电源负极
A、放电时,a电极反应为 B、放电时,溶液中离子的数目增大 C、充电时,b电极每增重 ,溶液中有 被氧化 D、充电时,a电极接外电源负极二、非选择题
-
7. 氮、磷、砷 、锑 、铋 、镆 为元素周期表中原子序数依次增大的同族元素。回答下列问题:(1)、砷在元素周期表中的位置。 的中子数为。
已知: ( ,白磷)= ( ,黑磷) ;
( ,白磷)= ( ,红磷) ;
由此推知,其中最稳定的磷单质是。
(2)、氮和磷氢化物性质的比较:热稳定性: (填“>”“<”)。
沸点: (填“>”“<”),判断依据是。
(3)、 和 与卤化氢的反应相似,产物的结构和性质也相似。下列对 与 反应产物的推断正确的是(填序号)。a.不能与 反应 b.含离子键、共价键 c.能与水反应
(4)、 能发生较强烈的水解,生成难溶的 ,写出该反应的化学方程式 , 因此,配制 溶液应注意。
(5)、在1L真空密闭容器中加入a mol PH4I固体,时发生如下反应:
①②
③
达平衡时,体系中 , , ,则 ℃时反应①的平衡常数 值为(用字母表示)。8. 我国化学家首次实现了膦催化的 环加成反应,并依据该反应,发展了一条合成中草药活性成分茅苍术醇的有效路线。已知 环加成反应:

( 、 可以是 或 )

回答下列问题:
(1)、茅苍术醇的分子式为 , 所含官能团名称为 , 分子中手性碳原子(连有四个不同的原子或原子团)的数目为。(2)、化合物B的核磁共振氢谱中有个吸收峰;其满足以下条件的同分异构体(不考虑手性异构)数目为。①分子中含有碳碳三键和乙酯基
②分子中有连续四个碳原子在一条直线上
写出其中碳碳三键和乙酯基直接相连的同分异构体的结构简式。
(3)、 的反应类型为。(4)、 的化学方程式为 , 除 外该反应另一产物的系统命名为。(5)、下列试剂分别与 和 反应,可生成相同环状产物的是(填序号)。a. b. c. 溶液
(6)、参考以上合成路线及条件,选择两种链状不饱和酯,通过两步反应合成化合物 ,在方框中写出路线流程图(其他试剂任选)。 9. 环己烯是重要的化工原料。其实验室制备流程如下:
9. 环己烯是重要的化工原料。其实验室制备流程如下: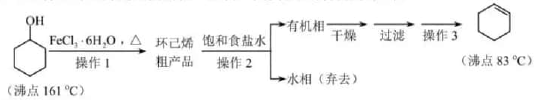
回答下列问题:
(1)、Ⅰ.环己烯的制备与提纯原料环己醇中若含苯酚杂质,检验试剂为 , 现象为。
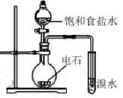
(2)、操作1的装置如图所示(加热和夹持装置已略去)。
①烧瓶A中进行的可逆反应化学方程式为 , 浓硫酸也可作该反应的催化剂,选择 而不用浓硫酸的原因为(填序号)。
a.浓硫酸易使原料碳化并产生
b. 污染小、可循环使用,符合绿色化学理念
c.同等条件下,用 比浓硫酸的平衡转化率高
②仪器B的作用为。
(3)、操作2用到的玻璃仪器是。(4)、将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石, , 弃去前馏分,收集83℃的馏分。(5)、Ⅱ.环己烯含量的测定在一定条件下,向 环己烯样品中加入定量制得的 ,与环己烯充分反应后,剩余的 与足量 作用生成 ,用 的 标准溶液滴定,终点时消耗 标准溶液 (以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①

②
③
滴定所用指示剂为。样品中环己烯的质量分数为(用字母表示)。
(6)、下列情况会导致测定结果偏低的是(填序号)。a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c. 标准溶液部分被氧化
10. 多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
回答下列问题:
(1)、Ⅰ.硅粉与 在300℃时反应生成 气体和 ,放出 热量,该反应的热化学方程式为。 的电子式为。(2)、Ⅱ.将 氢化为 有三种方法,对应的反应依次为:①
②
③
氢化过程中所需的高纯度 可用惰性电极电解 溶液制备,写出产生 的电极名称(填“阳极”或“阴极”),该电极反应方程式为。
 (3)、已知体系自由能变 , 时反应自发进行。三个氢化反应的 与温度的关系如图1所示,可知:反应①能自发进行的最低温度是;相同温度下,反应②比反应①的 小,主要原因是。(4)、不同温度下反应②中 转化率如图2所示。下列叙述正确的是(填序号)。
(3)、已知体系自由能变 , 时反应自发进行。三个氢化反应的 与温度的关系如图1所示,可知:反应①能自发进行的最低温度是;相同温度下,反应②比反应①的 小,主要原因是。(4)、不同温度下反应②中 转化率如图2所示。下列叙述正确的是(填序号)。a.B点: b. :A点 点 c.反应适宜温度: ℃
(5)、反应③的 (用 , 表示)。温度升高,反应③的平衡常数 (填“增大”、“减小”或“不变”)。(6)、由粗硅制备多晶硅过程中循环使用的物质除 、 和 外,还有(填分子式)。