2019年高考理综化学真题试卷(北京卷)
试卷更新日期:2019-06-09 类型:高考真卷
一、选择题
-
1. 下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是( )A、4.03米大口径碳化硅反射镜
 B、2022年冬奥会聚氨酯速滑服
B、2022年冬奥会聚氨酯速滑服  C、能屏蔽电磁波的碳包覆银纳米线
C、能屏蔽电磁波的碳包覆银纳米线  D、“玉兔二号”钛合金筛选网轮
D、“玉兔二号”钛合金筛选网轮  2. 下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)( )A、
2. 下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)( )A、 NaCl溶于水
B、
NaCl溶于水
B、  电解CuCl2溶液
C、
电解CuCl2溶液
C、  CH3COOH在水中电离
D、H2(g)+Cl2(g)=2HCl(g) △H=183kJ·mol-1
CH3COOH在水中电离
D、H2(g)+Cl2(g)=2HCl(g) △H=183kJ·mol-1  H2与Cl2反应能量变化
3. 2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟( )等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷( )同周期。下列说法不正确的是( )
H2与Cl2反应能量变化
3. 2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟( )等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷( )同周期。下列说法不正确的是( )
A、 是第五周期第 族元素 B、 的中子数与电子数的差值为17 C、原子半径: D、碱性:4. 交联聚合物P的结构片段如图所示。下列说法不正确的是(图中 表示链延长)( )
表示链延长)( )  A、聚合物P中有酯基,能水解 B、聚合物P的合成反应为缩聚反应 C、聚合物P的原料之一丙三醇可由油脂水解获得 D、邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构5. 下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( )
A、聚合物P中有酯基,能水解 B、聚合物P的合成反应为缩聚反应 C、聚合物P的原料之一丙三醇可由油脂水解获得 D、邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构5. 下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( ) A、A B、B C、C D、D6. 探究草酸( )性质,进行如下实验。(已知:室温下, 的pH=1.3)
A、A B、B C、C D、D6. 探究草酸( )性质,进行如下实验。(已知:室温下, 的pH=1.3)
由上述实验所得草酸性质所对应的方程式不正确的是( )
A、 有酸性, B、酸性: , C、 有还原性, D、 可发生酯化反应,7. 实验测得 溶液、 溶液以及 的pH随温度变化的曲线如图所示。下列说法正确的是( ) A、随温度升高,纯水中 B、随温度升高, 的溶液的 减小 C、随温度升高, 的溶液的pH变化是 改变与水解平衡移动共同作用的结果 D、随水温升高, 溶液和 溶液的pH均降低,是因为 、 水解平衡移动方向不同
A、随温度升高,纯水中 B、随温度升高, 的溶液的 减小 C、随温度升高, 的溶液的pH变化是 改变与水解平衡移动共同作用的结果 D、随水温升高, 溶液和 溶液的pH均降低,是因为 、 水解平衡移动方向不同二、非选择题
-
8. 抗癌药托瑞米芬的前体K的合成路线如下。

已知:
i.

ii. 有机物结构可用键线式表示,如 的键线式为
 (1)、有机物A能与 溶液反应产生 ,其钠盐可用于食品防腐。有机物 能与 溶液反应,但不产生 ;B加氢可得环己醇。A和B反应生成C的化学方程式是 , 反应类型是。(2)、D中含有的官能团:。(3)、E的结构简式为。(4)、F是一种天然香料,经碱性水解、酸化,得G和J。J经还原可转化为G。J的结构简式为。(5)、M是J的同分异构体,符合下列条件的M的结构简式是。
(1)、有机物A能与 溶液反应产生 ,其钠盐可用于食品防腐。有机物 能与 溶液反应,但不产生 ;B加氢可得环己醇。A和B反应生成C的化学方程式是 , 反应类型是。(2)、D中含有的官能团:。(3)、E的结构简式为。(4)、F是一种天然香料,经碱性水解、酸化,得G和J。J经还原可转化为G。J的结构简式为。(5)、M是J的同分异构体,符合下列条件的M的结构简式是。① 包含2个六元环
② M可水解,与 溶液共热时,1 mol M最多消耗 2 mol
(6)、推测E和G反应得到K的过程中,反应物 和H2O的作用是。(7)、由K合成托瑞米芬的过程:
托瑞米芬具有反式结构,其结构简式是。
9. 化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。Ⅰ.用已准确称量的 固体配制一定体积的 标准溶液;
Ⅱ.取 L上述溶液,加入过量 ,加 酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入 L废水
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用
 标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗 溶液 L。
标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗 溶液 L。 已知:
和 溶液颜色均为无色
(1)、Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和。(2)、Ⅱ中发生反应的离子方程式是。(3)、Ⅲ中发生反应的化学方程式是。(4)、Ⅳ中加 前,溶液颜色须为黄色,原因是。(5)、 与 物质的量关系为 时, 一定过量,理由是。(6)、V中滴定至终点的现象是。(7)、废水中苯酚的含量为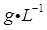 (苯酚摩尔质量:
(苯酚摩尔质量:  ) (8)、由于 具有性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。10. 氢能源是最具有应用前景的能源之一,高纯氢的制备是目前的研究热点。(1)、甲烷水蒸气催化重整是制高纯氢的方法之一。
) (8)、由于 具有性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。10. 氢能源是最具有应用前景的能源之一,高纯氢的制备是目前的研究热点。(1)、甲烷水蒸气催化重整是制高纯氢的方法之一。①反应器中初始反应的生成物为 和 ,其物质的量之比为4:1,甲烷和水蒸气反应的方程式是。
②已知反应器中还存在如下反应:
i.
ii.
iii. ·
Ⅲ为积碳反应,利用 和 计算 时,还需要利用 反应的
③反应物投料比采用 ,大于初始反应的化学计量数之比,目的是(选填字母序号)
a.促进 转化
b.促进 转化为
c.减少积碳生成
④用 可以去除 。 体积分数和 消耗率随时间变化关系如下图所示。

从 时开始, 体积分数显著降低,单位时间 消耗率(填“升高”“降低”或“不变”)。此时 消耗率约为 ,但已失效,结合化学方程式解释原因:。
(2)、可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接 或 ,可交替得到 和 。
①制 时,连接。
产生 的电极方程式是。
②改变开关连接方式,可得 。
③结合①和②中电极3的电极反应式,说明电极3的作用:。
11. 化学小组实验探究 与 溶液的反应。(1)、实验一:用如下装置(夹持、加热仪器略)制备 ,将足量 通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。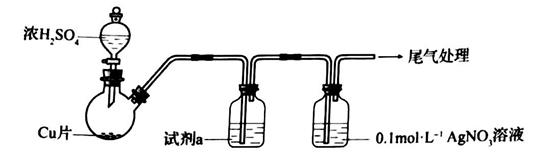
①浓 与Cu反应的化学方程式是
②试剂a是。
(2)、对体系中有关物质性质分析得出:沉淀B可能为 、 或二者混合物。(资料: 微溶于水; 难溶于水)
实验二:验证B的成分

①写出 溶于氨水的离子方程式:。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是 ,进而推断B中含有 。向滤液E中加入一种试剂,可进一步证实B中含有 。所用试剂及现象是。
(3)、根据沉淀F的存在,推测 的产生有两个途径:途径1:实验一中, 在 溶液中被氧化生成 ,随沉淀B进入D。
途径2:实验二中, 被氧化为 进入D。
实验三:探究 的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有;取上层清液继续滴加 溶液,未出现白色沉淀,可判断B中不含 。做出判断的理由:。
②实验三的结论:。
(4)、实验一中 与 溶液反应的离子方程式是。(5)、根据物质性质分析, 与 溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和SO42-生成。根据上述实验所得结论:。