北京市顺义区2017-2018学年高一下学期化学期末考试试卷
试卷更新日期:2019-06-04 类型:期末考试
一、单选题
-
1. 阿司匹林具有抗血小板凝聚的作用。其有效成分是乙酰水杨酸(C9H8O4)。乙酰水杨酸属于( )A、单质 B、氧化物 C、氢化物 D、有机化合物2. 下列各组元素中,属于同一主族的是( )A、N、Cl B、O、S C、H、Mg D、Na、 Al3. 电解质是一类在水溶液里或熔融状态下能够导电的化合物。下列物质属于电解质的是( )A、碳 B、氯化钾溶液 C、氢氧化钠 D、稀硫酸4. 下列物质属于高分子化合物的是( )A、乙烷 B、乙醇 C、聚乙烯 D、乙酸乙酯5. 下列关于Na性质的描述错误的是( )A、密度大于水 B、银白色固体 C、与水反应 D、熔点较低6. 下列同周期元素中,原子半径最大的是( )A、Al B、Mg C、Si D、Cl7. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、乙醇溶液 B、葡萄糖溶液 C、氢氧化钠溶液 D、氢氧化铁胶体8. 下图为某城市某日空气质量报告,下列叙述与报告内容不相符的是( )
 A、该日空气首要污染物是PM10 B、该日空气质量等级属于中度污染 C、污染物NO2、CO可能主要来源于机动车尾气 D、PM2.5、PM10指的是悬浮颗粒物,会影响人体健康9. 丝绸之路贸易中的下列商品,主要成分属于合金的是( )
A、该日空气首要污染物是PM10 B、该日空气质量等级属于中度污染 C、污染物NO2、CO可能主要来源于机动车尾气 D、PM2.5、PM10指的是悬浮颗粒物,会影响人体健康9. 丝绸之路贸易中的下列商品,主要成分属于合金的是( )A.青铜器皿
B.陶瓷
C.丝绸
D.中草药



 A、A B、B C、C D、D10. 下列物质中,只含有离子键的是( )A、NaOH B、CO2 C、MgCl2 D、Na2O211. 催化还原CO2是解决温室效应及能源问题的重要手段之一。在恒容密闭容器中,CO2和H2在催化剂作用下发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g)。CO2、H2、CH3OH、H2O的浓度均不再改变时,下列说法正确的是( )A、CO2、H2、CH3OH、H2O的浓度一定相等 B、该反应已经达到化学平衡状态 C、CO2和H2完全转化为CH3OH和H2O D、CO2、H2的反应速率等于CH3OH、H2O的反应速率且为零12. 原电池原理的发现改变了人们的生活方式。关于下图所示原电池的说法错误的是( )
A、A B、B C、C D、D10. 下列物质中,只含有离子键的是( )A、NaOH B、CO2 C、MgCl2 D、Na2O211. 催化还原CO2是解决温室效应及能源问题的重要手段之一。在恒容密闭容器中,CO2和H2在催化剂作用下发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g)。CO2、H2、CH3OH、H2O的浓度均不再改变时,下列说法正确的是( )A、CO2、H2、CH3OH、H2O的浓度一定相等 B、该反应已经达到化学平衡状态 C、CO2和H2完全转化为CH3OH和H2O D、CO2、H2的反应速率等于CH3OH、H2O的反应速率且为零12. 原电池原理的发现改变了人们的生活方式。关于下图所示原电池的说法错误的是( ) A、该装置将化学能转化为电能 B、电子由铜片经导线流向锌片 C、铜片上发生的反应为2H+ + 2e-=H2 D、该装置使氧化反应和还原反应分别在两个不同的区域进行13. 碘( )可用于医学放射的贝塔射线破坏甲状腺滤泡或杀死癌细胞而达到治疗甲亢、甲状腺癌和甲状腺癌转移灶的目的。下列关于 的说法正确的是( )A、质子数为53 B、中子数为131 C、质量数为184 D、核外电子数为7814. 糖类、油脂和蛋白质是生命活动所必需的营养物质。下列物质中不属于糖类的是( )A、蔗糖 B、淀粉 C、葡萄糖 D、油脂15. 下列反应属于加成反应的是( )A、乙醇与氧气反应生成乙醛 B、甲烷与氯气反应生成一氯甲烷 C、乙烯与溴反应生成1,2-二溴乙烷 D、乙醇与乙酸反应生成乙酸乙酯16. 下列方法不能用来鉴别乙醇和乙酸的是( )A、观察溶液颜色 B、加入碳酸氢钠溶液 C、加入紫色石蕊溶液 D、加入酸性高锰酸钾溶液17. 某粒子的结构示意图为
A、该装置将化学能转化为电能 B、电子由铜片经导线流向锌片 C、铜片上发生的反应为2H+ + 2e-=H2 D、该装置使氧化反应和还原反应分别在两个不同的区域进行13. 碘( )可用于医学放射的贝塔射线破坏甲状腺滤泡或杀死癌细胞而达到治疗甲亢、甲状腺癌和甲状腺癌转移灶的目的。下列关于 的说法正确的是( )A、质子数为53 B、中子数为131 C、质量数为184 D、核外电子数为7814. 糖类、油脂和蛋白质是生命活动所必需的营养物质。下列物质中不属于糖类的是( )A、蔗糖 B、淀粉 C、葡萄糖 D、油脂15. 下列反应属于加成反应的是( )A、乙醇与氧气反应生成乙醛 B、甲烷与氯气反应生成一氯甲烷 C、乙烯与溴反应生成1,2-二溴乙烷 D、乙醇与乙酸反应生成乙酸乙酯16. 下列方法不能用来鉴别乙醇和乙酸的是( )A、观察溶液颜色 B、加入碳酸氢钠溶液 C、加入紫色石蕊溶液 D、加入酸性高锰酸钾溶液17. 某粒子的结构示意图为 , 关于该粒子的说法正确的是( ) A、核外电子数为16 B、在化学反应中易得电子 C、属于金属元素 D、在周期表中位于第3周期 第ⅥA族18. 下列物质的电子式书写正确的是( )A、
, 关于该粒子的说法正确的是( ) A、核外电子数为16 B、在化学反应中易得电子 C、属于金属元素 D、在周期表中位于第3周期 第ⅥA族18. 下列物质的电子式书写正确的是( )A、 B、
B、 C、
C、 D、
D、 19. 下列关于自然界中氮循环(如图)的说法错误的是( )
19. 下列关于自然界中氮循环(如图)的说法错误的是( ) A、雷电作用是氮元素被氧化 B、豆科植物的根瘤固氮属于人工固氮 C、含氮无机物和含氮有机物可相互转化 D、碳、氢、氧三种元素也参与了氮循环20. 控制变量是科学研究的重要方法。向2 mL H2O2溶液中滴入2滴1 mol/LCuSO4溶液,下列条件下分解速率最快的是( )
A、雷电作用是氮元素被氧化 B、豆科植物的根瘤固氮属于人工固氮 C、含氮无机物和含氮有机物可相互转化 D、碳、氢、氧三种元素也参与了氮循环20. 控制变量是科学研究的重要方法。向2 mL H2O2溶液中滴入2滴1 mol/LCuSO4溶液,下列条件下分解速率最快的是( )选项
A
B
C
D
H2O2溶液的物质的量浓度(mol·L−1)
1
1
4
4
反应的温度(℃)
5
40
5
40
A、A B、B C、C D、D21. 实验室中,下列行为不符合安全要求的是( )A、稀释浓硫酸时,将浓硫酸缓慢注入水中并搅拌 B、实验结束后将废液倒入指定容器中 C、金属钠着火时,立即用水扑灭 D、在通风橱内制备有毒气体22. 下列说法中,正确的是( )A、标准状况下,3.6 g H2O的物质的量为0.1 mol B、常温常压下,11.2 L N2物质的量为0.5 mol C、1 mol/L MgCl2溶液中Cl-的物质的量为1 mol D、22 g CO2的摩尔质量为44g/mol23. 下列解释事实的离子方程式书写错误的是( )A、向氯化铁溶液中加入铁粉,颜色变浅:Fe3++ Fe = 2Fe2+ B、向碳酸钠溶液中滴加稀盐酸,产生气体:CO32-+ 2H+= CO2↑ + H2O C、向氯化钠溶液中滴加硝酸银溶液,生成沉淀:Ag+ + Cl-= AgCl ↓ D、向氯化钡溶液中滴加稀硫酸,生成沉淀:Ba2++ SO42-= BaSO4 ↓24. 下列实验装置或操作与实验目的不相符的是( )



A.除去水中泥沙
B.收集氨气
C.分离CCl4和H2O
D.配制100 mL 0.1 mol·L−1 NaCl溶液
A、A B、B C、C D、D25. 下列“解释或结论”与“实验操作及现象”不对应的是( )选项
实验操作及现象
解释或结论
A.
向某溶液中逐滴加入盐酸,产生无色无味气体
此溶液中一定含有CO32-
B.
将干燥和湿润的红色布条,分别放入盛有氯气的集气瓶中,湿润的红色布条褪色
氯气与水反应一定产生具有漂白性的物质
C.
将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,产生大量白烟
NH3遇到HCl时反应生成NH4Cl晶体
D.
向某溶液中逐滴加入NaOH溶液,立即产生白色沉淀,迅速变成灰绿,最终变成红褐色
此溶液中一定含有Fe2+
A、A B、B C、C D、D二、填空题
-
26. 中国首款完全自主知识产权民用客机C919的钛合金用量达9.3%。制备海绵钛的化学方程式为TiCl4 + 2Mg = 2MgCl2 + Ti。该反应中,Ti元素的价态发生(填“升高”或“降低”);作为还原剂的物质是 , 若反应中消耗了1 mol Mg,则 生成 mol Ti。27. 请从A和B两题中任选1个作答,若两题均作答,按A评分。
A
B
在3种无机物①Cl2、②Na2CO3、
③NH3中,可用作食用碱的是
(填序号,下同),可用于制漂白液的是 , 可用作制冷剂的是。
在3种有机物①乙醇、②乙烯、③乙酸中,可用作医用消毒剂的是(填序号,下同),用于除水壶中水垢的是 , 可作为水果催熟剂的是。
28. 现有下列4种物质:①浓H2SO4、②NO2、③NH4Cl、④NaHCO3。其中,可以使蔗糖变黑的是(填序号);与水发生反应由红棕变为无色的是(填序号);加热分解,遇冷又化合的是(填序号);加热分解生产无色无味气体的反应方程式是。三、综合题
-
29. 已知乙烯能发生如下转化:
 (1)、乙烯的结构简式是。(2)、乙酸乙酯中的官能团是。(3)、③的反应类型是。(4)、②的化学反应方程式是。30. 元素周期表与元素周期律在学习、研究和生产实践中有重要的作用。下表列出①~⑩十种元素在周期表中的位置。请用化学用语回答下列问题:
(1)、乙烯的结构简式是。(2)、乙酸乙酯中的官能团是。(3)、③的反应类型是。(4)、②的化学反应方程式是。30. 元素周期表与元素周期律在学习、研究和生产实践中有重要的作用。下表列出①~⑩十种元素在周期表中的位置。请用化学用语回答下列问题:
IA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
⑤
⑧
3
①
③
④
⑦
⑨
4
②
⑥
⑩
(1)、②的元素符号是。(2)、在①、②、③三种元素中,原子半径由大到小的顺序依次是。(3)、①、⑧二种元素形成的化合物,在高温下灼烧,火焰呈。(4)、⑦、⑨二种元素的最高价氧化物对应水化物的酸性较强的是 , 用原子结构理论解释:。(5)、⑤元素的氢化物实验室制法的化学方程式是。此反应的能量变化示意图如右图所示,该反应是反应(选填“放热”或“吸热”),判断依据是。 (6)、对⑥元素的说法正确的是(填字母)。
(6)、对⑥元素的说法正确的是(填字母)。a. ⑥的非金属性强于⑤
b. 氢化物稳定性:⑥<⑩
c. 最高价氧化物对应水化物的酸性:⑥<⑤
31. 用软锰矿[主要成分MnO2 , 还含Fe2O3、Cu2(OH)2CO3及少量不溶于水和酸的杂质]和酸洗厂废酸液(含1mol/LH2SO4的FeSO4溶液)联合生产硫酸锰和铁红(Fe2O3),生产过程如下图:
Mn(OH)2
Fe(OH)2
Cu(OH)2
Fe(OH)3
开始沉淀时
8.3
6.3
4.7
2.7
完全沉淀时
9.8
8.3
6.7
3.6
(1)、过程①~④所涉及的实验操作方法中,包含过滤的有(写序号)。(2)、溶液1中,先通入O2 , 其作用是。(3)、由固体2得到铁红的化学方程式是。(4)、下列说法正确的是(填字母)。a.过程①中有氧化还原反应发生
b.加入MnS的目的是除去溶液中的Cu2+ , 增大Mn2+
c.溶液1中含有的阳离子主要是Fe2+、Fe3+、Cu2+、Mn2+、H+
四、实验题
-
32. 某研究小组制备氯气并对产生氯气的条件进行探究。
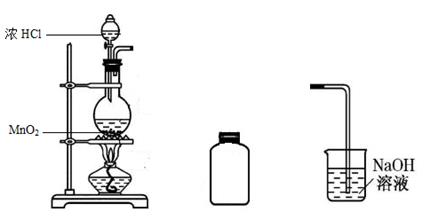
(1)、装置A中用MnO2与浓盐酸反应制取Cl2 , 利用了浓HCl的(填“氧化性”或“还原性”)。(2)、A中产生的气体不纯,含有的杂质可能是。(3)、B用于收集Cl2 , 请完善装置B并用箭头标明进出气体方向。(4)、C用于吸收多余的Cl2 , C中发生反应的离子方程式是。(5)、该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。实验
操作
现象
I
常温下将MnO2和12 mol·L-1浓盐酸混合
溶液呈浅棕色,略有刺激性气味
II
将I中混合物过滤,加热滤液
生成大量黄绿色气体
III
加热MnO2和4 mol·L-1稀盐酸混合物
无明显现象
①已知MnO2呈弱碱性。I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是。
②II中发生了分解反应,反应的化学方程式是。
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV进行探究:
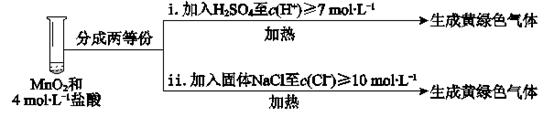
将实验III、IV作对比,得出的结论是;将i、ii作对比,得出的结论是。
33. 研究金属与硝酸的反应,实验如下。实验(20oC)
现象
Ⅰ.过量铜粉、2 mL 0.5 mol/L HNO3
无色气体(遇空气变红棕色),溶液变为蓝色
Ⅱ.过量铁粉、2 mL 0.5 mol/L HNO3
6 mL无色气体(经检测为H2),溶液几乎无色
(1)、Ⅰ中的无色气体是。(2)、Ⅱ中生成H2的离子方程式是。(3)、研究Ⅱ中的氧化剂① 甲同学认为该浓度的硝酸中H+的氧化性大于NO3- , 所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法错误,其实验证据是。
② 乙同学通过分析,推测出NO3-也能被还原,依据是 , 进而他通过实证实该溶液中含有NH4+ , 其实验操作是。
(4)、根据实验,金属与硝酸反应时,影响硝酸还原产物不同的因素有;试推测还可能有哪些因素影响(列举1条)。