2016年江苏省扬州市中考化学试卷
试卷更新日期:2017-05-23 类型:中考真卷
一、选择题
-
1. 扬州创建成为“国家生态市”,下列做法与此不相符的是( )
 A、节能减排,利用太阳能光伏发电 B、绿色出行,提倡乘坐公共交通工具 C、方便生活,推广使用一次性塑料餐盒 D、变废为宝,回收秸秆加工为生物柴油2. 下列物质属于化合物的是( )A、硫 B、水 C、铜 D、空气3. 下列过程仅包含物理变化的是( )A、矿石粉碎 B、钢铁生锈 C、食物变质 D、葡萄酿酒4. 下列物质由分子构成的是( )A、铁 B、干冰 C、氯化钠 D、金刚石5. 下列食物富含淀粉的是( )A、青菜 B、大米 C、鸡蛋 D、猪肉6. 下列物质加入到稀硫酸中,有大量气泡产生的是( )A、Zn B、Cu C、K2SO4 D、NaOH7. NaClO2广泛用于造纸工业,NaClO2中氯元素的化合价为( )A、﹣1 B、0 C、+3 D、+58. 下列属于温室气体的是( )A、H2 B、N2 C、O2 D、CO29. 下列属于复分解反应的是( )A、2H2O 2H2↑+O2↑ B、H2+CuO Cu+H2O C、3Fe+2O2 Fe3O4 D、AgNO3+NaCl═AgCl↓+NaNO310. 为了减缓铁制品的锈蚀,下列做法不当的是( )A、在车船的表面喷涂油漆 B、将使用后的菜刀用布擦干 C、洗净铁制品表面的油膜 D、在铁制品表面镀上一层锌11. 下列为“禁止烟火”标志的是( )A、
A、节能减排,利用太阳能光伏发电 B、绿色出行,提倡乘坐公共交通工具 C、方便生活,推广使用一次性塑料餐盒 D、变废为宝,回收秸秆加工为生物柴油2. 下列物质属于化合物的是( )A、硫 B、水 C、铜 D、空气3. 下列过程仅包含物理变化的是( )A、矿石粉碎 B、钢铁生锈 C、食物变质 D、葡萄酿酒4. 下列物质由分子构成的是( )A、铁 B、干冰 C、氯化钠 D、金刚石5. 下列食物富含淀粉的是( )A、青菜 B、大米 C、鸡蛋 D、猪肉6. 下列物质加入到稀硫酸中,有大量气泡产生的是( )A、Zn B、Cu C、K2SO4 D、NaOH7. NaClO2广泛用于造纸工业,NaClO2中氯元素的化合价为( )A、﹣1 B、0 C、+3 D、+58. 下列属于温室气体的是( )A、H2 B、N2 C、O2 D、CO29. 下列属于复分解反应的是( )A、2H2O 2H2↑+O2↑ B、H2+CuO Cu+H2O C、3Fe+2O2 Fe3O4 D、AgNO3+NaCl═AgCl↓+NaNO310. 为了减缓铁制品的锈蚀,下列做法不当的是( )A、在车船的表面喷涂油漆 B、将使用后的菜刀用布擦干 C、洗净铁制品表面的油膜 D、在铁制品表面镀上一层锌11. 下列为“禁止烟火”标志的是( )A、 B、
B、 C、
C、 D、
D、 12. 下列物质的用途仅与其物理性质有关的是( )A、用金刚石切割玻璃 B、用氢气作高能燃料 C、用生石灰作干燥剂 D、用小苏打治疗胃酸过多13. 阿司匹林的分子式为C9H8O4 , 下列关于阿司匹林的说法正确的是( )A、H、O原子个数比为1:8 B、相对分子质量为180 C、阿司匹林中含21种元素 D、氧元素的质量分数最小14. 下列关于实验现象的描述不正确的是( )A、向酚酞试液中通入氨气,溶液变红 B、向淀粉溶液中滴加碘水,溶液变蓝 C、向石蕊试液中通入二氧化碳,溶液变蓝 D、灼烧羊毛,有灼烧羽毛的气味产生15. 某反应前后分子变化的微观示意图如下,下列说法正确的是( )
12. 下列物质的用途仅与其物理性质有关的是( )A、用金刚石切割玻璃 B、用氢气作高能燃料 C、用生石灰作干燥剂 D、用小苏打治疗胃酸过多13. 阿司匹林的分子式为C9H8O4 , 下列关于阿司匹林的说法正确的是( )A、H、O原子个数比为1:8 B、相对分子质量为180 C、阿司匹林中含21种元素 D、氧元素的质量分数最小14. 下列关于实验现象的描述不正确的是( )A、向酚酞试液中通入氨气,溶液变红 B、向淀粉溶液中滴加碘水,溶液变蓝 C、向石蕊试液中通入二氧化碳,溶液变蓝 D、灼烧羊毛,有灼烧羽毛的气味产生15. 某反应前后分子变化的微观示意图如下,下列说法正确的是( ) A、反应物与生成物共有5种物质 B、反应后原子的个数增多 C、该图可示意SO2与O2的反应 D、该反应属于分解反应16. 在“配制一定溶质质量分数的氯化钠溶液”实验中,下列操作正确的是( )
A、反应物与生成物共有5种物质 B、反应后原子的个数增多 C、该图可示意SO2与O2的反应 D、该反应属于分解反应16. 在“配制一定溶质质量分数的氯化钠溶液”实验中,下列操作正确的是( )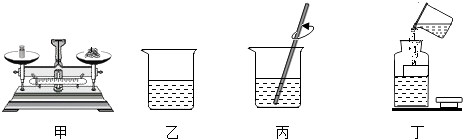 A、甲图表示称取7.5g氯化钠 B、乙图表示量取42.5mL水 C、丙图表示溶解氯化钠 D、丁图表示向试剂瓶中转移溶液17. KNO3与NaCl的溶解度曲线如图所示.下列说法正确的是( )
A、甲图表示称取7.5g氯化钠 B、乙图表示量取42.5mL水 C、丙图表示溶解氯化钠 D、丁图表示向试剂瓶中转移溶液17. KNO3与NaCl的溶解度曲线如图所示.下列说法正确的是( ) A、KNO3的溶解度大于NaCl的溶解度 B、加水能使NaCl的饱和溶液变为不饱和溶液 C、t1℃时,KNO3溶液与NaCl溶液溶质的质量分数相等 D、用冷却热饱和溶液的方法,能使KNO3从溶液中结晶析出18. 除去下列物质中的少量杂质,所选试剂及操作都正确的是( )
A、KNO3的溶解度大于NaCl的溶解度 B、加水能使NaCl的饱和溶液变为不饱和溶液 C、t1℃时,KNO3溶液与NaCl溶液溶质的质量分数相等 D、用冷却热饱和溶液的方法,能使KNO3从溶液中结晶析出18. 除去下列物质中的少量杂质,所选试剂及操作都正确的是( )序号
物质
杂质
试剂
操作
A
Cu(NO3)2溶液
AgNO3溶液
Cu
过滤
B
Na2CO3
NaHCO3
盐酸
结晶
C
Fe
Cu
稀硫酸
过滤
D
CO2
HCl
NaOH溶液
洗气
A、A B、B C、C D、D19. 某科学家除去空气中的O2与CO2得N2样品,并在相同条件下比较等体积的样品质量(m1)与纯N2质量(m2),重复多次,结果均为m1>m2 , 样品中含哪种气体可解释该结果( )A、氖 B、氩 C、甲烷 D、水蒸气20. 以FeSO4为原料制备铁黑颜料Fe3O4(其中Fe既有+2价,也有+3价)的过程如图:
“转化”过程的反应为:4Fe(OH)2+O2+2H2O═4Fe(OH)3 . 若原料中含FeSO49.12t,下列说法正确的是( )
A、理论上与FeSO4反应的NaOH溶液的质量为4.8t B、理论上“转化”过程参与反应的O2的质量为320kg C、该方法理论上最终可以获得Fe3O4的质量为4.64t D、若“转化”过程参与反应的O2过量,则最终所得固体的质量偏小二、解答题
-
21. 化学用语是学习化学的重要工具.(1)、写出下列微粒的化学符号:
①镁离子;②二氧化氮分子;
③5个硅原子;④硝酸分子;
(2)、用下列字母序号填空:a.硫酸铜 b.氯化钠 c.氮气 d.石墨
①用作调味品和防腐剂;②用作粮食保护气;
③用语配制波尔多液;④用语生产铅笔芯;
(3)、写出下列反应的化学方程式:①盐酸与氢氧化钠溶液反应;②铝与氧气反应;
③一氧化碳与氧化铁反应;④用高锰酸钾制取氧气 .
22. 化学与生活密切相关.(1)、如表为某女士一天的营养摄入量与推荐摄入量的比较(部分).①蛋白质、油脂和葡萄糖中属于高分子化合物的是 . ②钙、铁、硒三种元素中,在人体内含量最高(填元素名称,下同),缺易得贫血症,该女士摄入的没有达到推荐摄入量.项目
摄入量
推荐摄入量
蛋白质(g)
72.9
65
脂肪(g)
65.1
48.2~72.3
维生素C(mg)
176
100
钙(mg)
807
800
铁(mg)
21
20
硒(mg)
0.037
0.05
(2)、制造汽车使用了镁铝合金、玻璃钢、聚氯乙烯等材料.①上述材料中属于金属材料的是 , 属于合成材料的是 , 属于复合材料的是 . ②将镁铝合金与铝片相互刻画,在铝片表面留下明显划痕,说明镁铝合金的硬度铝的硬度(填“大于”或“小于”).
 23. 水是人类宝贵的资源.(1)、下列物质加入水中能形成溶液的是 , 能形成乳浊液的是 . (填序号)
23. 水是人类宝贵的资源.(1)、下列物质加入水中能形成溶液的是 , 能形成乳浊液的是 . (填序号)a.植物油 b.蔗糖 c.粉笔灰
(2)、下列溶液pH>7的是 , pH<7的是 . (填序号)a.食盐水 b.白醋 c.肥皂水
(3)、NaCl溶于水,难溶于植物油;NaCl在热水中溶解的质量比在等质量的冷水中溶解的质量大.这说明,物质的溶解能力与和有关.(4)、净化水常用的方法有沉降、过滤、吸附和蒸馏水,活性炭在净水器中能起到过滤和的作用,从盐水中获得饮用水,可采取的方法是 .24. CO2的资源化利用日趋成为研究热点.(1)、某小组查阅资料发现:①CO2与H2能在催化剂表面反应生成CH4与H2O;②CH4在高温下能与CuO反应.为探究上述反应,设计如下装置.
①仪器M的名称是 . 装置B中反应的化学方程式为 .
②设计装置C的目的是 , 若要证明D中有CO2生成,则需在E、F之间增加盛有溶液的洗气瓶.
③一段时间后,装置D中黑色固体变红,E中白色固体变蓝,该小组由此得出结论:以上实验证明CH4在高温条件下能与CuO反应.你是否同意他们的结论?(填“同意”或“不同意”),理由是 .
(2)、CH4、乙炔(C2H2)和丙烷(CH3H8)都能在空气中燃烧,但是仅C2H2燃烧时有浓烟.试从物质组成的角度分析其燃烧现象不同的原因是: . CH4燃料电池具有洁净、高效的特点,其工作时主要是将能转化为电能.25. CaCO3在生产生活中有广泛的用途.(1)、煅烧石灰石可制得活性CaO,反应的化学方程式为 . 为测定不同煅烧温度对CaO活性的影响,取石灰石样品分为三等分,在同一设备中分别于800℃、900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示.可知:CaO与水反应会热量(填“放出”或“吸收”);上述温度中,℃煅烧所得CaO活性最高.要得出正确结论,煅烧时还需控制的条件是 .(2)、以电石渣[主要成分为Ca(OH)2 , 还含有少量MgO等杂质]为原料制备高纯CaCO3的流程如下:
①如图为NH4Cl浓度对钙、镁浸出率的影响(浸出率= ×100%).可知:较适宜的NH4Cl溶液的质量分数为;浸取时主要反应的化学方程式为 .
②流程中虚线内部分若改用溶液(填化学式),可一步得到与原流程完全相同的生成物.
③流程中虚线内部若改用Na2CO3溶液,也能得到高纯CaCO3 , 试从生物的角度分析原流程的优点:
a.NH3可循环利用;b. .
 26. 硫酸铜在纺织、印刷等行业有广泛用途.(1)、工业上可用铜屑、空气与稀硫酸在80℃条件下制备硫酸铜.
26. 硫酸铜在纺织、印刷等行业有广泛用途.(1)、工业上可用铜屑、空气与稀硫酸在80℃条件下制备硫酸铜.
①如图1是实验室模拟工业制备硫酸铜的装置.反应的化学方程式为 , 采用水浴加热的优点是 , 多孔球泡的作用为 .
②工业生产时可用纯氧代替空气.这一措施能加快反应速率外,还具有的优点是③实验室用H2O2溶液和MnO2制备O2 , 反应的化学方程式为 , 在图2中,应选用的发生装置为(填序号,下同),收集装置为 .
(2)、以CuSO4为原料制备碱式碳酸铜[Cu2(OH)2CO3]的过程如图3:
①“沉淀”时的反应为:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2+CO2↑
②检验沉淀是否洗涤干净选用的试剂是(填化学式),烘干时产品中出现少量黑色物质,可能的原因为 .
③若所得产品的产率(产率= ×100%)偏高,其可能的原因为(填序号)
a.反应物为完全沉淀 b.过滤时滤纸破损
c.Cu2(OH)2CO3未洗涤干净 d.Cu2(OH)2CO3未完全烘干
④“沉淀”时若有少量5Cu(OH)2•2CuCO3生成,则产品中铜元素的质量分数(填“偏大”“不变”或“偏小”)
(3)、T℃时加热32.0g硫酸铜,一段时间后得到15.2gCuO和Cu2O的混合物,计算该混合物中CuO的质量(写出计算过程)