2016年江苏省南通市中考化学试卷
试卷更新日期:2017-05-23 类型:中考真卷
一、选择题
-
1. 生活与环境密切相关.下列做法有利于保护环境的是( )A、田间焚烧秸秆 B、回收废旧电池 C、随意排放污水 D、直接排放废气2. “分类”是学习化学的重要方法.下列说法正确的是( )A、塑料和棉花都属于合成材料 B、蛋白质和糖类都属于营养物质 C、液态氨气和氨水均为纯净物 D、氮气和氧气均为化学性质活泼的气体3. 用KMnO4制取O2并回收MnO2 , 下列操作或装置不正确的是( )A、
 制取O2
B、
制取O2
B、 收集O2
C、
收集O2
C、 产物加水搅拌
D、
产物加水搅拌
D、 过滤得MnO2
4. 下列说法正确的是( )A、硬水洗涤衣物适宜使用肥皂 B、二氧化锰可作所有反应的催化剂 C、吸入甲醛或一氧化碳会危害人体健康 D、铝合金与钢铁相比具有密度大、易腐蚀的特点5. 有关物质性质与应用的叙述不正确的是( )A、盐酸具有酸性,可用于洗涤油污 B、熟石灰具有碱性,可用来改良酸性土壤 C、活性炭具有吸附性,可用于去除冰箱异味 D、氮气具有不活泼性,可用作焊接金属的保护气6. NH4Cl和NaCl的溶解度随温度变化如图所示,下列说法正确的是( )
过滤得MnO2
4. 下列说法正确的是( )A、硬水洗涤衣物适宜使用肥皂 B、二氧化锰可作所有反应的催化剂 C、吸入甲醛或一氧化碳会危害人体健康 D、铝合金与钢铁相比具有密度大、易腐蚀的特点5. 有关物质性质与应用的叙述不正确的是( )A、盐酸具有酸性,可用于洗涤油污 B、熟石灰具有碱性,可用来改良酸性土壤 C、活性炭具有吸附性,可用于去除冰箱异味 D、氮气具有不活泼性,可用作焊接金属的保护气6. NH4Cl和NaCl的溶解度随温度变化如图所示,下列说法正确的是( ) A、NH4Cl的溶解度一定大于NaCl B、将NaCl溶液降温一定会有NaCl固体析出 C、50℃时饱和溶液的溶质质量分数为50% D、将t℃时,NH4Cl和NaCl的饱和溶液加热至50℃,两溶液的溶质质量分数相等7. 将红色的铜丝置于酒精灯火焰上加热,表面变黑.将变黑的铜丝插入盛有稀硫酸的试管中一段时间.有关说法不正确的是( )A、铜丝表面变黑,质量增加 B、变黑的铜丝插入稀硫酸,表面恢复红色 C、变黑的铜丝插入稀硫酸,铜丝质量不变 D、变黑的铜丝插入稀硫酸,溶液质量增加8. 下列物质的提纯所用试剂和主要实验操作均正确的是( )
A、NH4Cl的溶解度一定大于NaCl B、将NaCl溶液降温一定会有NaCl固体析出 C、50℃时饱和溶液的溶质质量分数为50% D、将t℃时,NH4Cl和NaCl的饱和溶液加热至50℃,两溶液的溶质质量分数相等7. 将红色的铜丝置于酒精灯火焰上加热,表面变黑.将变黑的铜丝插入盛有稀硫酸的试管中一段时间.有关说法不正确的是( )A、铜丝表面变黑,质量增加 B、变黑的铜丝插入稀硫酸,表面恢复红色 C、变黑的铜丝插入稀硫酸,铜丝质量不变 D、变黑的铜丝插入稀硫酸,溶液质量增加8. 下列物质的提纯所用试剂和主要实验操作均正确的是( )物质(括号内为杂质)
所用试剂
主要实验操作
A
Na2CO3(NaCl)
水
溶解、过滤
B
H2(HCl)
NaOH溶液
洗气
C
KCl(NaOH)
盐酸
溶解、蒸发结晶
D
KNO3溶液(KOH)
FeCl3溶液
沉淀、过滤
A、A B、B C、C D、D9. 通过下列实验,能达到实验目的是( )A、 验证HCl分子发生了运动
B、
验证HCl分子发生了运动
B、 验证质量守恒定律
C、
验证质量守恒定律
C、 验证浓硫酸遇水放热
D、
验证浓硫酸遇水放热
D、 验证氧气支持燃烧
10. 物质X的化学式为H2C2O4 , 可发生如下反应:
验证氧气支持燃烧
10. 物质X的化学式为H2C2O4 , 可发生如下反应:aH2C2O4 bH2O↑+cCO2↑+dY↑
取90g X,在t℃完全分解,产物通过足量浓硫酸,浓硫酸增重18g,另取90gX,在t℃完全分解,产物通过足量碱石灰(CaO和NaOH的固体混合物),碱石灰增重62g,则下列说法不正确的是(已知气体Y不与浓硫酸或碱石灰发生反应)( )
A、CO2的质量为44g B、气体Y的质量为28g C、气体Y可能为甲烷 D、方程式中b和c的比为1:1二、非选择题
-
11. 从微观的角度了解物质及其变化,有助于更好的认识物质组成和变化的本质.(1)、氟原子的结构示意图为
 ,则x= , 在化学反应中氟原子易(填“得到”或“失去“)电子. (2)、铝原子失去3个电子形成离子的离子符号为 .(3)、如图为Mn和CuSO4溶液反应的示意图,回答下列问题:
,则x= , 在化学反应中氟原子易(填“得到”或“失去“)电子. (2)、铝原子失去3个电子形成离子的离子符号为 .(3)、如图为Mn和CuSO4溶液反应的示意图,回答下列问题:①实际与Mn反应的粒子是;
②反应中失去电子的粒子是;
③由反应可知金属的活泼性:MnCu(填“>”或“<”);
④该反应中化合价没有改变的元素或根是(填对应选项的字母).
A.锰元素 B.铜元素 C.硫酸根.
 12. 柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:
12. 柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图: (1)、写出反应1的化学方程式: , 该反应属于基本反应类型中的反应;(2)、操作1的名称为;(3)、写出反应2的化学方程式:;(4)、反应3中会有气体生成,该气体是;(5)、柠檬酸亚铁的化学式为FeC6H6O7 , 柠檬酸亚铁中铁元素和碳元素质量比为 .13. 煤的综合利用有利于保护自然环境和社会的可持续发展.
(1)、写出反应1的化学方程式: , 该反应属于基本反应类型中的反应;(2)、操作1的名称为;(3)、写出反应2的化学方程式:;(4)、反应3中会有气体生成,该气体是;(5)、柠檬酸亚铁的化学式为FeC6H6O7 , 柠檬酸亚铁中铁元素和碳元素质量比为 .13. 煤的综合利用有利于保护自然环境和社会的可持续发展. (1)、由煤的结构片段可知:煤的组成元素中除C、H、O、S外还含有(填元素符号).(2)、煤的焦化属于变化;焦化获得的焦炭可用于高炉炼铁,高炉内CO和Fe2O3反应的化学方程式为;焦化获得的氨气可用于制取氮肥,区分(NH4)2SO4和K2SO4两种化肥可选用的试剂是(填对应选项的字母).
(1)、由煤的结构片段可知:煤的组成元素中除C、H、O、S外还含有(填元素符号).(2)、煤的焦化属于变化;焦化获得的焦炭可用于高炉炼铁,高炉内CO和Fe2O3反应的化学方程式为;焦化获得的氨气可用于制取氮肥,区分(NH4)2SO4和K2SO4两种化肥可选用的试剂是(填对应选项的字母).A.氯化钡 B.盐酸 C.熟石灰
(3)、煤的气化过程中主要反应是碳与水蒸气生成两种气体燃料,其中一种是单质,该单质是 .(4)、提高煤的燃烧效率能节约煤炭资源,写出一种提高煤的燃烧效率的方法: . 煤中加入适量石灰石燃烧,可发生反应:2CaCO3+O2+2SO2 2CaSO4+2CO2 , 煤中加入石灰石对环境的意义是 .14. 为验证水的组成元素及探究水在电极端所发生的变化,兴趣小组用如图1所示装置(夹持仪器省略)进行实验:
Ⅰ.验证水的组成元素
步骤一:向长颈漏斗中加水(含少量Na2SO4)至充满管a和管b.关闭活塞,接通电源,一段时间后关闭电源.
步骤二:检验管中气体.
(1)、Na2SO4在水中能解离出 , 增强了水的导电性;(2)、电解时观察到的现象有:;(3)、用燃着的木条分别置于玻璃管尖嘴口,打开活塞,若观察到 , 则证明气体为H2;若观察到 , 则证明气体为O2 .(4)、某同学提出实验后还需检验Na2SO4的质量是否发生变化,其原因是 .(5)、若要确定水中氢、氧元素的原子个数比,需要测定 .(6)、Ⅱ.探究水在电极端所发生的变化步骤一:向装置中重新加水(含少量Na2SO4)至充满管a和管b,保持活塞打开,接通电源,一段时间后关闭电源.
步骤二:分别取出管a和管b电极附近的溶液,并测定溶液的pH.
①测定溶液pH的方法是:用玻璃棒蘸取溶液,滴到pH试纸上,把试纸显示的颜色与 , 读取pH.经测定:管a中溶液pH小于7,管b中溶液液pH大于7.
②管b溶液呈性,若向溶液中加入 , 溶液变为红色,也能得出此结论.
③图2中能表示电解时管a中水在电极端所发生变化的结果的是(填对应选项的字母).
15. 某同学取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,如图: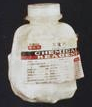 (1)、塑料试剂瓶膨胀破裂的原因是 , 反应的化学方程式为 .(2)、破裂后瓶内试剂会吸收空气中CO2生成CaCO3 . 为测定其中CaCO3的质量分数,兴取小组分别进行如下实验:
(1)、塑料试剂瓶膨胀破裂的原因是 , 反应的化学方程式为 .(2)、破裂后瓶内试剂会吸收空气中CO2生成CaCO3 . 为测定其中CaCO3的质量分数,兴取小组分别进行如下实验:实验1:称取10.0g样品,加50.0g水溶解,搅拌、静置、过滤,将沉淀洗涤、干燥、称重.
实验2:称取10.0g样品,向其中加入足量稀盐酸,充分反应,收集产生的气体.
①根据实验1称重计算样品中CaCO3的质量分数可能偏高,原因是 .
②若实验2中收集的气体为2.2g,计算样品中CaCO3的质量分数 . (请写出计算过程)