2014年江苏省南通市中考化学试卷
试卷更新日期:2017-05-23 类型:中考真卷
一、选择题
-
1. 未成年人正处于生长发育阶段,需要摄入比成年人更多的常量元素是( )A、钙 B、硒 C、碘 D、锌2. 粗盐提纯需经过称量、溶解、过滤、蒸发等操作,下列图示对应的操作不规范的是( )A、
 称量
B、
称量
B、 溶解
C、
溶解
C、 过滤
D、
过滤
D、 蒸发
3. 水是最常见的物质,以下与水有关的说法正确的是( )A、地球上水资源丰富,人类不缺淡水 B、水由2个氢原子和1个氧原子构成 C、生活中可以用食盐水区别硬水和软水 D、水在通电条件下可分解为氢气和氧气4. 下列物质的名称、化学式、分类均正确的是( )A、硫酸钠 NaSO4 盐 B、氧化钙 CaO 氧化物 C、烧碱 KOH 碱 D、甲烷 CH4 无机物5. 下列实验中,仪器和用品的选择不合理的是( )
蒸发
3. 水是最常见的物质,以下与水有关的说法正确的是( )A、地球上水资源丰富,人类不缺淡水 B、水由2个氢原子和1个氧原子构成 C、生活中可以用食盐水区别硬水和软水 D、水在通电条件下可分解为氢气和氧气4. 下列物质的名称、化学式、分类均正确的是( )A、硫酸钠 NaSO4 盐 B、氧化钙 CaO 氧化物 C、烧碱 KOH 碱 D、甲烷 CH4 无机物5. 下列实验中,仪器和用品的选择不合理的是( ) A、收集CO2气体﹣⑥⑦⑧ B、检验一瓶气体是否为O2﹣⑦⑧⑨ C、用H2O2溶液和MnO2制O2﹣①② D、用大理石和稀盐酸制CO2﹣③④⑤6. 下列有关物质性质与用途的说法均正确的是( )A、一氧化碳具有还原性,可用于铁的冶炼 B、金属铝不能与氧气反应,常用于制作炊具 C、碳酸钠能与酸反应,常用于治疗胃酸过多 D、活性炭具有吸附性,常用于自来水杀菌消毒7. 盐场晒盐后所得的卤水中含有MgCl2 , KCl和MgSO4等物质,它们的溶解度曲线如图所示,下列说法正确的是( )
A、收集CO2气体﹣⑥⑦⑧ B、检验一瓶气体是否为O2﹣⑦⑧⑨ C、用H2O2溶液和MnO2制O2﹣①② D、用大理石和稀盐酸制CO2﹣③④⑤6. 下列有关物质性质与用途的说法均正确的是( )A、一氧化碳具有还原性,可用于铁的冶炼 B、金属铝不能与氧气反应,常用于制作炊具 C、碳酸钠能与酸反应,常用于治疗胃酸过多 D、活性炭具有吸附性,常用于自来水杀菌消毒7. 盐场晒盐后所得的卤水中含有MgCl2 , KCl和MgSO4等物质,它们的溶解度曲线如图所示,下列说法正确的是( ) A、MgSO4的溶解度始终随温度的升高而减小 B、t1℃时,KCl和MgSO4两溶液所含溶质质量一定相等 C、t2℃时,100gMgCl2的饱和溶液中含有agMgCl2 D、将t1℃时的KCl饱和溶液升温到t2℃,溶液由饱和变为不饱和8. 根据下列实验和现象不能判定有新物质生成的是(图中夹持仪器省略)( )A、
A、MgSO4的溶解度始终随温度的升高而减小 B、t1℃时,KCl和MgSO4两溶液所含溶质质量一定相等 C、t2℃时,100gMgCl2的饱和溶液中含有agMgCl2 D、将t1℃时的KCl饱和溶液升温到t2℃,溶液由饱和变为不饱和8. 根据下列实验和现象不能判定有新物质生成的是(图中夹持仪器省略)( )A、 有红色固体出现
B、
有红色固体出现
B、 有白色晶体析出
C、
有白色晶体析出
C、 红色消失
D、
红色消失
D、 有大量气泡出现
9. 下列说法正确的是( )A、用紫色石蕊试液可以区分氢氧化钠溶液和澄清石灰水 B、用适量的BaCl2溶液可除去KNO3溶液中混有的K2SO4 C、将铁钉分别置于干燥空气、潮湿空气中,可探究水对铁锈蚀的影响 D、配制一定溶质质量分数的稀硫酸时,应将水倒入浓硫酸中稀释10. 地球大气的演化经历了原始大气、次生大气和现在大气三个阶段,次生大气中部分成分的微观示意图如下:
有大量气泡出现
9. 下列说法正确的是( )A、用紫色石蕊试液可以区分氢氧化钠溶液和澄清石灰水 B、用适量的BaCl2溶液可除去KNO3溶液中混有的K2SO4 C、将铁钉分别置于干燥空气、潮湿空气中,可探究水对铁锈蚀的影响 D、配制一定溶质质量分数的稀硫酸时,应将水倒入浓硫酸中稀释10. 地球大气的演化经历了原始大气、次生大气和现在大气三个阶段,次生大气中部分成分的微观示意图如下:甲
乙
丙




一定条件下,3.4g甲物质和4.8g氧气恰好完全反应,生成5.4g乙物质和另一种物质X,下列判断不正确的是( )
A、物质甲的化学式是NH3 B、物质X的质量为2.8g C、物质X含两种元素 D、该反应化学方程式中物质X与O2的化学计量之比为2:3二、非选择题
-
11. 近年来,页岩气的开发与利用越来越受重视.页岩气是从页岩层中开采出来的天然气,属于(选填“可再生”或“不可再生”)能源;页岩气经压缩、冷却,可以(填物态变化名称)成液态,此过程(选填“吸收”或“放出”)热量.12. 了解物质的组成与结构,有助于认识物质的性质:(1)、如图表示核电荷数为11~17的元素最高和最低化合价.
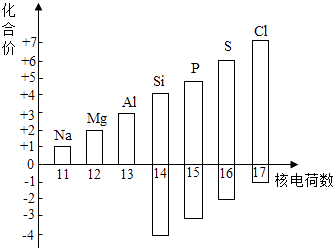
①从图中可以看出,氯元素的最高正价是 .
②若某元素既可显正价,又可显负价,则最高正价与最低负价绝对值的代数和为 .
③写出图中元素的化合价随着核电荷数递增的一条变化规律: .
(2)、在金属活动性顺序表里,通常排在前面的金属更容易失去电子,回答下列问题:①某金属原子的结构示意图为
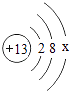 ,则最外层电子数x=;若最外层电子失去,达到相对稳定结构,该带电粒子的符号为 .
,则最外层电子数x=;若最外层电子失去,达到相对稳定结构,该带电粒子的符号为 . ②我国古代发明了“曾青(即硫酸铜)得铁化为铜”的湿法炼铜法,请用化学方程式表示反应原理:;该反应中,更易失去电子的金属是 .
13. 七水硫酸镁(MgSO4•7H2O)是一种重要的化工原料,在48.1℃以下的潮湿空气中稳定,在湿热干燥空气中易失去结晶水,工业上将白云石(主要成分为MgCO3 , CaCO3)碳烧成粉,用于制取MgSO4•7H2O,工艺流程如图所示. (1)、煅烧过程中,MgCO3转化为MgO的基本反应类型是;(2)、写出MgO与H2SO4反应的化学方程式:;(3)、操作a的名称为;(4)、将分离后的母液循环利用的目的是;(5)、干燥得成品时,需要控制的条件是 .14. 空气是一种宝贵的自然资源,要保护空气,防止污染空气.
(1)、煅烧过程中,MgCO3转化为MgO的基本反应类型是;(2)、写出MgO与H2SO4反应的化学方程式:;(3)、操作a的名称为;(4)、将分离后的母液循环利用的目的是;(5)、干燥得成品时,需要控制的条件是 .14. 空气是一种宝贵的自然资源,要保护空气,防止污染空气. (1)、分离液化空气可获得氮气和两种气体,氮气用作保护气,说明氮气 .(2)、利用膜分离技术,在一定压力下让空气通过具有富集氧气功能的薄膜,能得到含氧量较高的富氧空气,该过程发生变化.(3)、某燃煤电厂富氧燃烧技术原理图如图所示:
(1)、分离液化空气可获得氮气和两种气体,氮气用作保护气,说明氮气 .(2)、利用膜分离技术,在一定压力下让空气通过具有富集氧气功能的薄膜,能得到含氧量较高的富氧空气,该过程发生变化.(3)、某燃煤电厂富氧燃烧技术原理图如图所示:①富氧燃烧与普通燃烧相比,能提供更多的O2 , 使锅炉中的CO充分燃烧,请写出CO燃烧的化学方程式:;
②采用该技术有利于对CO2捕捉、封存和利用,减少碳排放,获得的CO2可用于制干冰,干冰的用途之一是 , 捕捉CO2也可用NaOH溶液,请写出对应的化学方程式:;
③采用图中工艺,可以使煤燃烧产生的氮氧化物和气体的排放总量大大下降,从而有效防止酸雨的形成.
15. 实验室使用块状石灰石(CaCO3)和稀盐酸制CO2 , 当观察不到有气泡产生,固体仍有剩余时,通常认为反应结束,剩余液呈中性,某兴趣小组对此进行了以下探究.【实验操作】
向试管中加入5粒石灰石,倾倒约试管体积 的稀盐酸(1:1);观察不到气泡中,仍有固体剩余;将试管静置.
(1)、取上层清液,用pH试纸测得溶液pH=2,说明溶液是性;pH测定中,“上层清液滴到试纸上”的后一步操作是 .(2)、【实验思考Ⅰ】反应剩余液中有哪些物质?其中能使溶液pH=2的有哪些?【实验探究Ⅰ】
甲同学通过实验排除了CaCl2的可能性,简述其实验方案: .
乙同学将CO2通入蒸馏水中至饱和,测得pH>5.
综合甲、乙两同学实验,得出的结论是:剩余液中还含有 .
(3)、【实验思考Ⅱ】试管中剩余固体中是否仍含有CaCO3?【实验探究Ⅱ】小组同学向试管中继续加入稀盐酸(1:1),又有大量气泡产生.
①由此得出的结论是;写出反应的化学方程式: .
②比较稀盐酸加入前后的实验现象,解释“又有大量气泡产生”的原因: .
(4)、【拓展延伸】①反应剩余液放置一段时间后,溶液pH增大,其主要原因是 .
②假如用100g14.6%的稀盐酸和足量的石灰石反应,看不到气泡产生时,停止收集气体,收集到的CO2质量(填“>”、“<”或“=”)8.8g.
16. 一定条件下,糖类(按C6H12O6计:相对分子质量为180)发酵生成乙醇(C2H5OH),也可发酵生成乙酸(CH3COOH).(1)、C6H12O6中C、H、O三种元素的质量比为 .(2)、某调味剂厂采用发酵技术生产的“原醋”中,乙酸的质量分数为10.5%,将100kg上述“原醋”稀释成分质量分数为3.5% 的食醋,需水的质量为 .(3)、糖类发酵生成乙醇的化学方程式为:C6H12O6═2C2H5OH+2CO2(反应条件省略,下同)
①求2.7kg上述糖理论上制乙醇的质量.(请将计算过程写出)
②糖类和乙醇在空气中燃烧的化学方程式分别为:
C6H12O6+6O2═6CO+6H2O
C2H5OH+3O2═2CO2+2H2O
已知完全燃烧2.7kg上述糖生成1.62kg的水,若将①中制得的乙醇完全燃烧,则生成水的质量为 .