2013年江苏省镇江市中考化学试卷
试卷更新日期:2017-05-23 类型:中考真卷
一、单项选择题
-
1. 下列属于化学变化的是( )A、蔗糖溶解 B、滴水成冰 C、花香四溢 D、铁器生锈2. 下列属于纯净物的是( )A、液态氧 B、加碘盐 C、酸牛奶 D、不锈钢3. 下列属于化学能转化为其它能量的是( )A、
 水力发电
B、
水力发电
B、 电解水
C、
电解水
C、 化学电池
D、
化学电池
D、 太阳能供热
4. 下列做法与社会可持续发展理念相违背的是( )A、将工业废水注入地下,治理水污染 B、研发可降解的塑料,减少“白色污染” C、开发新能源,代替化石燃料 D、推行自行车、公交车等出行方式,减少“碳”排放5. 下列归类错误的是( )
太阳能供热
4. 下列做法与社会可持续发展理念相违背的是( )A、将工业废水注入地下,治理水污染 B、研发可降解的塑料,减少“白色污染” C、开发新能源,代替化石燃料 D、推行自行车、公交车等出行方式,减少“碳”排放5. 下列归类错误的是( )选项
归类
物质
A
化石燃料
煤、石油、天然气
B
同一物质
烧碱、火碱、纯碱
C
营养物质
淀粉、蛋白质、油脂
D
复合材料
汽车轮胎、玻璃钢、钢筋混凝土
A、A B、B C、C D、D6. 按下列装置实验,不能达到对应目的是( )A、 收集H2
B、
收集H2
B、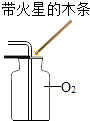 O2验满
C、
O2验满
C、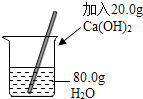 配制20%的Ca(OH)2溶液
D、
配制20%的Ca(OH)2溶液
D、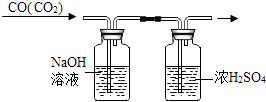 除去CO中的CO2
7. 下列做法正确的是( )A、用聚氯乙烯包装食品 B、常用钢丝球洗刷铝锅,使之光亮、耐用 C、将草木灰(含K2CO3)与氯化铵混合施用,增进肥效 D、利用石灰乳和硫酸铜溶液配制波尔多液8. 下列做法错误的是( )A、用灼烧的方法区别棉花和羊毛 B、用润湿的pH试纸测白醋的pH C、用水鉴别NH4NO3、NaOH、NaCl三种固体 D、按溶解、过滤、蒸发的主要操作顺序分离CaCl2、CaCO3的固体混合物9. 甲和乙反应可制备燃料丙,其微观示意图如图.下列说法错误的是( )
除去CO中的CO2
7. 下列做法正确的是( )A、用聚氯乙烯包装食品 B、常用钢丝球洗刷铝锅,使之光亮、耐用 C、将草木灰(含K2CO3)与氯化铵混合施用,增进肥效 D、利用石灰乳和硫酸铜溶液配制波尔多液8. 下列做法错误的是( )A、用灼烧的方法区别棉花和羊毛 B、用润湿的pH试纸测白醋的pH C、用水鉴别NH4NO3、NaOH、NaCl三种固体 D、按溶解、过滤、蒸发的主要操作顺序分离CaCl2、CaCO3的固体混合物9. 甲和乙反应可制备燃料丙,其微观示意图如图.下列说法错误的是( ) A、该反应属于化合反应 B、该反应中分子和原子的种类都发生了改变 C、甲、丙是有机物,乙是氧化物 D、甲、丙分别在氧气中完全燃烧,产物相同10. 下列实验操作或现象的描述正确的是( )A、将50.0mL酒精与50.0mL蒸馏水混合,所得溶液体积小于100.0mL B、向加碘食盐溶液中滴加淀粉,溶液变蓝 C、“粗盐提纯”实验中,过滤时将悬浊液直接倒入漏斗 D、硫在空气中燃烧发出明亮蓝紫色火焰,生成无色无味气体11. 下列化学方程式能正确表示所述内容的是( )A、铁丝在氧气中燃烧:4Fe+3O2 2Fe2O3 B、实验室制备CO2:CaCO3 CaO+CO2↑ C、盐酸除铁锈:Fe2O3+6HCl═2FeCl3+3H2O D、CO2通入CaCl2溶液中:CO2+CaCl2+H2O═CaCO3↓+2HCl12. 下列推理正确的是( )A、向某无色溶液中滴加酚酞无现象,则溶液一定呈中性 B、酸雨的pH小于7,pH小于7的雨水不一定是酸雨 C、在同一化合物中,金属元素显正价,则非金属元素一定显负价 D、酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应13. 下列除杂设计(括号内为杂质)所选用试剂和操作都正确的是( )
A、该反应属于化合反应 B、该反应中分子和原子的种类都发生了改变 C、甲、丙是有机物,乙是氧化物 D、甲、丙分别在氧气中完全燃烧,产物相同10. 下列实验操作或现象的描述正确的是( )A、将50.0mL酒精与50.0mL蒸馏水混合,所得溶液体积小于100.0mL B、向加碘食盐溶液中滴加淀粉,溶液变蓝 C、“粗盐提纯”实验中,过滤时将悬浊液直接倒入漏斗 D、硫在空气中燃烧发出明亮蓝紫色火焰,生成无色无味气体11. 下列化学方程式能正确表示所述内容的是( )A、铁丝在氧气中燃烧:4Fe+3O2 2Fe2O3 B、实验室制备CO2:CaCO3 CaO+CO2↑ C、盐酸除铁锈:Fe2O3+6HCl═2FeCl3+3H2O D、CO2通入CaCl2溶液中:CO2+CaCl2+H2O═CaCO3↓+2HCl12. 下列推理正确的是( )A、向某无色溶液中滴加酚酞无现象,则溶液一定呈中性 B、酸雨的pH小于7,pH小于7的雨水不一定是酸雨 C、在同一化合物中,金属元素显正价,则非金属元素一定显负价 D、酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应13. 下列除杂设计(括号内为杂质)所选用试剂和操作都正确的是( )序号
物 质
选用试剂
操作
A
CO2(CO)
O2
点燃
B
NaOH溶液(Na2CO3)
稀盐酸
加入试剂至不再产生气泡
C
KNO3溶液(KOH)
Cu(NO3)2溶液
加入适量的试剂,直接蒸发
D
蛋白质固体(蔗糖)
H2O、
饱和(NH4)2SO4溶液
溶解、盐析、过滤、
洗涤、低温干燥
A、A B、B C、C D、D14. 下列各组转化中,一定条件下均能一步实现的组合是( ) A、①② B、②③ C、①③ D、①②③15. 工业上以CaO和HNO3为原料制备Ca(NO3)2•6H2O晶体.为确保制备过程中既不补充水,也无多余的水,所用硝酸的溶质质量分数约为( )A、41.2% B、53.8% C、58.3% D、70.0%
A、①② B、②③ C、①③ D、①②③15. 工业上以CaO和HNO3为原料制备Ca(NO3)2•6H2O晶体.为确保制备过程中既不补充水,也无多余的水,所用硝酸的溶质质量分数约为( )A、41.2% B、53.8% C、58.3% D、70.0%二、不定项选择题
-
16. 下列说法正确的是( )A、氯化钠溶液会加快钢铁的锈蚀 B、洗洁精和汽油都能清洗油污,且原理相同 C、高炉炼铁中所需的高温和CO的生成都与焦炭有关 D、为了加强食品的色、香、味,可以大量使用添加剂17. 20℃时,将等质量的甲、乙固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2(不考虑水分蒸发),甲、乙固体的溶解度曲线如图3.

下列说法正确的是( )
A、图1中乙溶液一定不饱和 B、图2中两溶液中溶质质量分数不一定相等 C、图3中N表示甲的溶解度曲线 D、图2中两溶液降温至30℃一定都不会析出晶体18. 下列各组溶液,不用其他试剂不能鉴别出来的是( )A、Na2CO3、稀H2SO4、稀HCl、KNO3 B、稀HCl、Na2CO3、BaCl2、Na2SO4 C、NaOH、Na2CO3、酚酞、CaCl2 D、CuSO4、NaOH、BaCl2、NaCl19. 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,下列说法正确的是( ) A、a点溶液中的溶质有2种 B、c点溶液中溶质为Zn(NO3)2 C、若取b~c段溶液,滴加稀盐酸,有白色沉淀 D、取d点的固体,加入稀盐酸,无气泡产生20. 已知:Cu+2H2SO4(浓)
A、a点溶液中的溶质有2种 B、c点溶液中溶质为Zn(NO3)2 C、若取b~c段溶液,滴加稀盐酸,有白色沉淀 D、取d点的固体,加入稀盐酸,无气泡产生20. 已知:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O.有关CuSO4制备途径及性质如图所示.
CuSO4+SO2↑+2H2O.有关CuSO4制备途径及性质如图所示. 
下列说法正确的是( )
A、途径①比途径②更好地体现绿色化学思想 B、反应③分解所得混合气体X是SO2和SO3 C、反应③中有三种元素化合价发生变化 D、Y可以是葡萄糖,利用此反应可以检验病人是否患有糖尿病三、填空题
-
21. 用化学符号表示:(1)、3个氢分子;(2)、铝离子;(3)、空气中含量最多的气体;(4)、人体缺少元素,会导致甲状腺疾病.22. 请从下列物质中选择适当的物质填空(填字母编号):
A.小苏打 B.武德合金 C.硝酸钾 D.熟石灰 E.维生素 F.肥皂水 G.生石灰 H.干冰
(1)、可用作食品干燥剂;(2)、可作复合肥料;(3)、可用于治疗胃酸过多;(4)、制作保险丝;(5)、可用作人工降雨;(6)、蔬菜、水果中富含23. 如图表示某物质微观形成过程.请仔细观察并回答下列问题: (1)、图示形成的物质化学式为;(2)、该过程说明原子通过电子形成离子.24. 选择合适操作或仪器的序号填空.
(1)、图示形成的物质化学式为;(2)、该过程说明原子通过电子形成离子.24. 选择合适操作或仪器的序号填空.①坩埚钳 ②搅拌 ③10.0mL量筒 ④50.0mL量筒 ⑤加热
(1)、将浓硫酸注入水中,为使热量及时散发应;(2)、转移热的蒸发皿到石棉网上用;(3)、除去Na2CO3固体中的NaHCO3 , 操作是;(4)、量取8.8mL的H2O,应选择 .25. 向Fe粉与过量稀H2SO4反应后的溶液中滴加H2O2溶液,溶液由浅绿色变为黄色,无气泡产生;继续滴加H2O2溶液,有气泡出现;反应后滴加BaCl2溶液有白色沉淀.(1)、溶液由浅绿色变为黄色的化学反应方程式: .(2)、产生气泡的化学反应方程式: .四、实验题
-
26. 请结合下图回答问题:
 (1)、标号①②的仪器名称:① , ② .(2)、实验室选用A、D装置制取O2 , 气体收集完毕时,应先(填“从水中取出导气管”或“熄灭酒精灯”).(3)、实验室可用(NH4)2SO4固体和熟石灰混合加热制取NH3 , 应选择发生装置为(选填序号).(4)、选择发生装置B和收集装置(选填序号)可以用于实验室制取CO2 , 若将发生装置由B改为F,其优点是 .
(1)、标号①②的仪器名称:① , ② .(2)、实验室选用A、D装置制取O2 , 气体收集完毕时,应先(填“从水中取出导气管”或“熄灭酒精灯”).(3)、实验室可用(NH4)2SO4固体和熟石灰混合加热制取NH3 , 应选择发生装置为(选填序号).(4)、选择发生装置B和收集装置(选填序号)可以用于实验室制取CO2 , 若将发生装置由B改为F,其优点是 .①为了得到纯净、干燥的CO2 , 除杂装置(如图)的导管按气流方向连接顺序是(选填字母);
a.1→2→4→3 b.2→1→3→4
c.4→3→1→2 d.3→4→2→1
用化学反应方程式表示饱和NaHCO3溶液的作用 .
②写出用澄清石灰水检验CO2的化学反应方程式 .
 27. 某同学将光亮的镁条放入滴有酚酞的NaHCO3饱和溶液中,产生大量气泡和白色固体,溶液红色加深.(1)、(一)溶液红色加深,则反应后溶液的碱性(填“增强”、“不变”或“减弱”).(2)、(二)为确定气体和固体的成分,该同学进行了如下的探究.
27. 某同学将光亮的镁条放入滴有酚酞的NaHCO3饱和溶液中,产生大量气泡和白色固体,溶液红色加深.(1)、(一)溶液红色加深,则反应后溶液的碱性(填“增强”、“不变”或“减弱”).(2)、(二)为确定气体和固体的成分,该同学进行了如下的探究.点燃产生的气体,火焰淡蓝色;将燃烧产物通入澄清石灰水中,无现象.则该气体为(写化学式).
对白色固体做出如下猜测并进行实验:
【猜测】
查阅资料1:Mg(HCO3)2能溶于水.
①白色固体可能是MgCO3;
②白色固体可能是;
③白色固体可能是MgCO3和Mg(OH)2 .
【实验】
①取洗净后的白色固体,加入足量的溶液,观察到 , 则白色固体一定含有MgCO3 .
查阅资料2:MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物.
②为进一步确定白色固体的组成,该同学进行了定量实验:
称取干燥的白色固体22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部先通过浓硫酸,浓硫酸增重1.8g,则白色固体中含有 , 再通过碱石灰,碱石灰增重8.8g,则固体中各成分的质量比为 .
五、推断题
-
28. 有一包白色固体粉末,可能含有CuSO4、Na2SO4、(NH4)2CO3、BaCl2、NH4Cl、KCl中的一种或几种.现做如下实验:

根据上述实验现象判断:
(1)、白色固体中一定不含 , 一定含有 , 可能含有 .(2)、写出①中化学反应方程式 .(3)、写出②中化学反应方程式 .29. 如图表示某些物质间转化关系.A、D为固体且组成元素相同,A为紫黑色;X、F为液体且组成元素相同,X具有消毒杀菌作用;E为产生温室效应的常见气体,Y是一种红色的金属.请回答下列问题: (1)、D的化学式 , F的化学式;(2)、写出有关反应的化学方程式:②;⑤ .(3)、反应⑥在催化反应室中进行,且发生多个反应,请推断完成反应d的化学方程式:
(1)、D的化学式 , F的化学式;(2)、写出有关反应的化学方程式:②;⑤ .(3)、反应⑥在催化反应室中进行,且发生多个反应,请推断完成反应d的化学方程式:a.CH4+2H2O CO2+4H2 b.CH4 C+2H2
c.C+CO2 2CO d.CH4+ +3H2
(4)、利用合成气在一定条件下可合成化工产品乙醇(C2H6O),请写出该化学反应方程式; 结合反应②⑥,可看出CH4不仅可作燃料,而且是重要的原料.六、综合题
-
30. 某实验小组利用废硫酸液制备K2SO4并研究CaSO4•2H2O加热分解的产物.
(一)K2SO4的制备
 (1)、将CaCO3研成粉末的目的是(2)、上述流程中可循环使用的物质有CO2和(填写化学式).(3)、反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是
(1)、将CaCO3研成粉末的目的是(2)、上述流程中可循环使用的物质有CO2和(填写化学式).(3)、反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是物质
KCl
K2SO4
NH4Cl
M
溶解度/g(25℃)
34.0
11.1
37.2
19.5
(4)、不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入(选填序号,下同),振荡、静置,再向上层清液中滴加 , 观察现象即可判断.a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(5)、(二)研究CaSO4•2H2O加热分解的产物.分离所得的CaSO4•2H2O含有CaCO3 , 可用盐酸除去,该的化学反应方程式 .
(6)、为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验.
①实验前首先要 , 再装入样品.装置A的作用是 .
②已知CaSO4•2H2O在160℃生成CaSO4 , 1350℃时CaSO4开始分解;CaCO3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将(填“偏大”、“偏小”或“无影响”).你认为还可选用上述的(选填序号)两个数据组合也可求出x:y的值.
(7)、CaSO4•2H2O受热会逐步失去结晶水.取纯净CaSO4•2H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示.①G点固体的化学式是 .
②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,则H~I段发生反应的化学方程式为 .