2012年江苏省南通市中考化学试卷
试卷更新日期:2017-05-23 类型:中考真卷
一、选择题
-
1. 下列做法有利于保护环境的是( )A、开发洁净能源 B、丢弃废旧电池 C、大量使用化肥 D、焚烧废弃塑料2. 进行木炭在氧气中燃烧的实验有以下四个步骤,其中一定没有发生化学变化的是( )A、
 B、
B、 C、
C、 D、
D、 3. 对物质组成结构的认识错误的是( )A、构成物质的粒子之间一定存在间隙 B、酸碱的组成中,一定含有氢氧元素 C、原子中质子数一定等于核外电子数 D、化学变化中分子可以再分而原子不可分4. 下列实验基本操作正确的是( )A、
3. 对物质组成结构的认识错误的是( )A、构成物质的粒子之间一定存在间隙 B、酸碱的组成中,一定含有氢氧元素 C、原子中质子数一定等于核外电子数 D、化学变化中分子可以再分而原子不可分4. 下列实验基本操作正确的是( )A、 读取液体体积
B、
读取液体体积
B、 点燃酒精灯
C、
点燃酒精灯
C、 铁钉放入试管
D、
铁钉放入试管
D、 称取氯化钠
5. 锂电池是一种新型的高能电池.某种锂电池的总反应式可表示为:Li十MnO2═LiMnO2下列说法正确的是( )A、MnO2在该反应中作为催化剂 B、该反应属于置换反应 C、该反应发生了能量转化 D、反应前后锂元素的化合价不变6. 利用下列仪器制取相关气体,不能实现的是( )
称取氯化钠
5. 锂电池是一种新型的高能电池.某种锂电池的总反应式可表示为:Li十MnO2═LiMnO2下列说法正确的是( )A、MnO2在该反应中作为催化剂 B、该反应属于置换反应 C、该反应发生了能量转化 D、反应前后锂元素的化合价不变6. 利用下列仪器制取相关气体,不能实现的是( ) A、用锌和稀硫酸制取氢气 B、用双氧水和二氧化锰制取氧气 C、用高锰酸钾加热分解制取氧气 D、用石灰石和稀盐酸制取二氧化碳7. 如图是a、b两种固体物质的溶解度曲线.从图中获得的信息错误的是( )
A、用锌和稀硫酸制取氢气 B、用双氧水和二氧化锰制取氧气 C、用高锰酸钾加热分解制取氧气 D、用石灰石和稀盐酸制取二氧化碳7. 如图是a、b两种固体物质的溶解度曲线.从图中获得的信息错误的是( ) A、a物质的溶解度随温度升高而增大 B、30℃时,b物质的溶解度为20g C、t℃时,a、b的饱和溶液溶质质量分数相等 D、30℃时,b物质饱和溶液的溶质质量分数为20%8. 下列实验方案不能达到实验目的是( )A、用带火星的木条检验O2 B、用点燃的方法除去CO2中的CO C、用酚酞溶液鉴别食盐水和烧碱溶液 D、用Na2CO3溶液和Ca(OH)2溶液制备少量的NaOH溶液9. 下列问题的研究中,未利用对比实验思想方法的是( )A、
A、a物质的溶解度随温度升高而增大 B、30℃时,b物质的溶解度为20g C、t℃时,a、b的饱和溶液溶质质量分数相等 D、30℃时,b物质饱和溶液的溶质质量分数为20%8. 下列实验方案不能达到实验目的是( )A、用带火星的木条检验O2 B、用点燃的方法除去CO2中的CO C、用酚酞溶液鉴别食盐水和烧碱溶液 D、用Na2CO3溶液和Ca(OH)2溶液制备少量的NaOH溶液9. 下列问题的研究中,未利用对比实验思想方法的是( )A、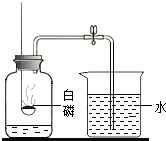 研究空气中氧气含量
B、
研究空气中氧气含量
B、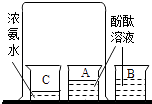 研究分子运动
C、
研究分子运动
C、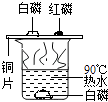 研究燃烧的条件
D、
研究燃烧的条件
D、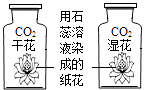 研究二氧化碳与水的反应
10. 以下应用守恒思想解决相关问题,推论正确的是( )A、14 g碳与32g氧气反应,根据质量守恒推出生成的二氧化碳的质量为46g B、聚乙烯燃烧生成二氧化碳和水,根据元素守恒推出聚乙烯由碳、氢、氧元素组成 C、50 mL36%的盐酸用50 mL水稀释,根据溶质守恒推出稀盐酸的溶质质量分数为l8% D、水电解生成H2和O2的分子数比为2:1,根据原子守恒推出水分子中H、O原子数比为2:1
研究二氧化碳与水的反应
10. 以下应用守恒思想解决相关问题,推论正确的是( )A、14 g碳与32g氧气反应,根据质量守恒推出生成的二氧化碳的质量为46g B、聚乙烯燃烧生成二氧化碳和水,根据元素守恒推出聚乙烯由碳、氢、氧元素组成 C、50 mL36%的盐酸用50 mL水稀释,根据溶质守恒推出稀盐酸的溶质质量分数为l8% D、水电解生成H2和O2的分子数比为2:1,根据原子守恒推出水分子中H、O原子数比为2:1二、解答题
-
11. 从微观的角度认识物质及其变化,更有助于了解物质组成及变化的本质.

 (1)、图1粒子中,属于阴离子的有(填序号,下同);在化学反应中最易失去电子的是;由②、③构成的物质的化学式为 .(2)、图1粒子所属元素可以组成多种化合物,请写出由上述某些元素组成的一种酸的化学式: , 一种碱的化学式: .(3)、如图2表示氢氧化钠溶液与盐酸反应的微观过程,该反应的本质是结合生成水.请写出一个与上述反应本质相同的化学反应方程式: .12. 某科研小组利用工业废酸(10%H2SO4)来浸泡含有氧化铜、氧化锌的废料,实现废物的综合利用.流程如下图所示:
(1)、图1粒子中,属于阴离子的有(填序号,下同);在化学反应中最易失去电子的是;由②、③构成的物质的化学式为 .(2)、图1粒子所属元素可以组成多种化合物,请写出由上述某些元素组成的一种酸的化学式: , 一种碱的化学式: .(3)、如图2表示氢氧化钠溶液与盐酸反应的微观过程,该反应的本质是结合生成水.请写出一个与上述反应本质相同的化学反应方程式: .12. 某科研小组利用工业废酸(10%H2SO4)来浸泡含有氧化铜、氧化锌的废料,实现废物的综合利用.流程如下图所示: (1)、写出氧化锌与硫酸反应的化学方程式: , Zn→Cu的化学方程式为 .(2)、物质X可用作氮肥,化学式为;该化肥不能与混合使用.(3)、请推出物质Y的化学式: .13. 海洋是个巨大的资源宝库,利用海水可制取许多化工产品.(1)、用海水制食盐,常通过得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量BaCl2溶液除去 , 再加溶液除去CaCl2和过量的BaCl2 , 生成的沉淀经除去.(2)、从海水中提取溴常用吹出法,即用氯气(Cl2)将海水里溴化钠(NaBr)中的溴置换出来,再用空气或水蒸气吹出溴(Br2).流程示意图如下:
(1)、写出氧化锌与硫酸反应的化学方程式: , Zn→Cu的化学方程式为 .(2)、物质X可用作氮肥,化学式为;该化肥不能与混合使用.(3)、请推出物质Y的化学式: .13. 海洋是个巨大的资源宝库,利用海水可制取许多化工产品.(1)、用海水制食盐,常通过得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量BaCl2溶液除去 , 再加溶液除去CaCl2和过量的BaCl2 , 生成的沉淀经除去.(2)、从海水中提取溴常用吹出法,即用氯气(Cl2)将海水里溴化钠(NaBr)中的溴置换出来,再用空气或水蒸气吹出溴(Br2).流程示意图如下:
①写出氯气置换出溴单质的化学方程式:;该反应在pH=3的酸性条件下进行,可用测定反应液的酸碱度.
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br2+SO2+2H2O═H2SO4+2HBr).根据流程图分析,通入SO2的目的是 .
14. 某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案.
实验准备:
(1)、用98%的浓硫酸配制10%的硫酸溶液.现有烧杯、玻璃棒、胶头滴管,还需要的仪器有;在稀释时,一定要 , 并不断搅拌.(2)、准备两块表面积相同的镁条和铝条,并除去表面的氧化膜.要求两种金属片表面积相同的原因是 .(3)、【方案一】将除去氧化膜的镁条、铝条,分别与相同体积相同质量分数的硫酸反应,观察到镁比铝反应更剧烈,说明 .(4)、【方案二】①连接仪器组装成如右图所示实验装置.某学生用抽拉法检查该装置的气密性,发现被拉出的针筒活塞一段时间后又回到原来的位置,你认为该装置是否漏气? .
②依次进行镁、铝与硫酸反应,写出镁与硫酸反应的化学方程式:;要比较两种金属活动性强弱,可以测定两种金属与硫酸反应得到相同体积氢气所需要的时间;还可测定 .
(5)、【方案三】请设计一个与上述实验不同的方案,比较镁和铝的金属活动性强弱: .15. 维生素C是一种人体必需的维生素.查阅资料可知下列信息:部分性质
生理作用
维生素C
化学式:C6H806
无色晶体,易溶于水;在酸性溶液
中稳定,中性或碱性溶液中易被空气氧化…
促进人体生长发育,增强人体对
疾病的抵抗能力…
请参与下列问题的讨论.
(1)、维生素C中碳、氢、氧三种元素的质量比为 . 现有黄瓜、馒头、牛肉,其中富含维生素C的是 .(2)、某兴趣小组的同学对维生素C的还原性进行实验探究,其实验结果如下图所示.实验说明了维生素C在空气中氧化除跟氧气有关外,还与有关.因此,生吃新鲜蔬菜要比熟吃蔬菜维生素C的损失 (选填“大”或“小”).
 (3)、该兴趣小组同学对某果计饮料中维生素C的含量进行测定,反应原理为:C6H8O6+I2═C6H6O6+2HI
(3)、该兴趣小组同学对某果计饮料中维生素C的含量进行测定,反应原理为:C6H8O6+I2═C6H6O6+2HI实验步骤如下:
a.取果汁饮料10mL,用煮沸并冷却的蒸馏水稀释到50mL
b.加醋酸溶液酸化
c.加入少量指示剂
d.逐滴加入稀碘水至完全反应,实验测得恰好反应时,消耗溶质碘的质量为25.4mg.计算该果汁饮料每100mL中含维生素C的质量为多少mg?(请将计算过程写在答题卡上)
(4)、有些同学在测定时,未加入醋酸溶液酸化,测得维生素C的含量明显小于其他同学.其原因是 .