山东省德州市宁津县2018-2019学年中考化学二模考试试卷
试卷更新日期:2019-05-27 类型:中考模拟
一、选择题(本题包括16小题,1-12每小题2分,13--16每小题3分,共36分。每小题只有一个选项符合题意)
-
1. 下列变化,属于物理变化的是( )A、活性炭脱色 B、铁钉生锈 C、食物腐败 D、烧碱变质2. 十三五发展规划中,提到五大发展理念,为实现绿色发展、减少水污染和大气污染,下列做法可取的是( )
①大力发展公共交通,减少机动车排污
②对排污企业一律关停,只发展零污染企业
③开发清洁能源,发展绿色经济
④加强对水源地和各类湿地的保护工作,开展环保宣传和志愿者服务活动
A、①③④ B、②③④ C、①②③ D、①②④3. 如图所示,下列实验操作正确的是( )A、 B、
B、 C、
C、 D、
D、 4. 樟脑是一种白色晶体(化学式为C10H16O),可以散发出特殊气味,使衣物免受虫蛀,下列有说法正确的是( )A、樟脑的相对分子质量为152g B、樟脑是由碳、氢、氧三个元素组成的 C、樟脑中碳元素的质量分数最大 D、樟脑的每个分子有3个原子构成5. 下列叙述正确的是( )A、决定原子质量大小的主要是质子和电子 B、分子能构成物质,而原子只能构成分子 C、原子核中一定含有质子和中子 D、原子得到或失去电子会形成离子6. “人造空气”帮助人类实现了“太空漫步”的梦想,这种“人造空气”中含有体积分数为70%的氮气、20%以上的氧气、还有二氧化碳。下列关于“人造空气”的说法中,不正确的是( )A、“人造空气”比空气中的氮气含量低 B、“人造空气”中供给航天员呼吸的是氧气 C、“人造空气”中的氧气和空气中的氧气化学性质相同 D、氮气对航天员呼吸没有任何作用,因此“人造空气”可以不需要氮气7. 体操运动员比赛时为了防滑,常在手掌上涂抹碳酸镁粉末。碳酸镁属于( )A、酸 B、碱 C、盐 D、氧化物8. 下列属于有机高分子材料的是( )A、玻璃钢 B、陶瓷 C、塑料 D、不锈钢9. 认识燃烧原理可以利用和控制燃烧。下列说法正确的是( )A、只要达到可燃物燃烧所需的最低温度,可燃物就能燃烧 B、室内起火,应该迅速打开所有门窗通风 C、高楼火灾逃生时,可用浸水的衣被、毛毯等遮裹全身,可有效防止“引火烧身” D、水能灭火,主要是因为水蒸发吸热,降低了可燃物的着火点10. 下列化学用语书写不正确的是( )A、氖气:Ne B、两个钡离子:2Ba2+ C、氨气(NH3)中氮元素的化合价: D、工业上炼铁原理:3C+2Fe2O3 4Fe+3CO2↑11. 如图为某化学反应的微观示意图,其中不同的球代表不同的原子。下列说法正确的是( )
4. 樟脑是一种白色晶体(化学式为C10H16O),可以散发出特殊气味,使衣物免受虫蛀,下列有说法正确的是( )A、樟脑的相对分子质量为152g B、樟脑是由碳、氢、氧三个元素组成的 C、樟脑中碳元素的质量分数最大 D、樟脑的每个分子有3个原子构成5. 下列叙述正确的是( )A、决定原子质量大小的主要是质子和电子 B、分子能构成物质,而原子只能构成分子 C、原子核中一定含有质子和中子 D、原子得到或失去电子会形成离子6. “人造空气”帮助人类实现了“太空漫步”的梦想,这种“人造空气”中含有体积分数为70%的氮气、20%以上的氧气、还有二氧化碳。下列关于“人造空气”的说法中,不正确的是( )A、“人造空气”比空气中的氮气含量低 B、“人造空气”中供给航天员呼吸的是氧气 C、“人造空气”中的氧气和空气中的氧气化学性质相同 D、氮气对航天员呼吸没有任何作用,因此“人造空气”可以不需要氮气7. 体操运动员比赛时为了防滑,常在手掌上涂抹碳酸镁粉末。碳酸镁属于( )A、酸 B、碱 C、盐 D、氧化物8. 下列属于有机高分子材料的是( )A、玻璃钢 B、陶瓷 C、塑料 D、不锈钢9. 认识燃烧原理可以利用和控制燃烧。下列说法正确的是( )A、只要达到可燃物燃烧所需的最低温度,可燃物就能燃烧 B、室内起火,应该迅速打开所有门窗通风 C、高楼火灾逃生时,可用浸水的衣被、毛毯等遮裹全身,可有效防止“引火烧身” D、水能灭火,主要是因为水蒸发吸热,降低了可燃物的着火点10. 下列化学用语书写不正确的是( )A、氖气:Ne B、两个钡离子:2Ba2+ C、氨气(NH3)中氮元素的化合价: D、工业上炼铁原理:3C+2Fe2O3 4Fe+3CO2↑11. 如图为某化学反应的微观示意图,其中不同的球代表不同的原子。下列说法正确的是( ) A、该反应属于置换反应 B、1个X分子中有4个原子 C、两种反应物均属于化合物 D、反应前后元素化合价均不改变12. 小冰同学对所学部分化学知识归纳如下,其中有错误的一组是( )
A、该反应属于置换反应 B、1个X分子中有4个原子 C、两种反应物均属于化合物 D、反应前后元素化合价均不改变12. 小冰同学对所学部分化学知识归纳如下,其中有错误的一组是( )A.物质的性质和用途
N2性质稳定——填充食品袋
CO具有还原——可冶炼金属
B.安全常识
酒精灯酒精溢出燃烧——用水浇灭
煤气泄漏——关闭气阀、打开门窗通风
C.化学与人体健康
缺钙——易得佝偻病或骨质疏松
缺锌——生长迟缓,发育不良
D.日常生活经验
区别矿泉水与蒸馏水——蒸干,看有无白色固体
区分羊毛纤维与合成纤维——灼烧后闻气味
A、A B、B C、C D、D13. 根据下列实验方案进行实验,能达到相应实验目的的是( )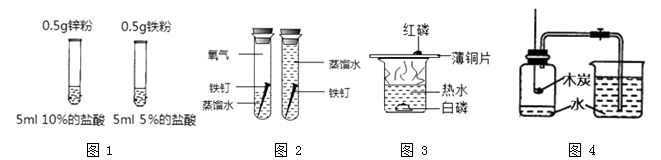 A、图 1 比较 Zn 和 Fe 的金属活动性强弱 B、图 2 探究铁钉生锈时 O2 是否参与反应 C、图 3 比较红磷和白磷的着火点 D、图 4 测定空气中 O2 的含量14. 逻辑推理是化学学习常用的思维方法,下列推理正确的是( )A、中和反应有盐和水生成,但是有盐和水生成的反应不一定是中和反应 B、单质是由同种元素组成的物质,所以由同种元素组成的物质一定是单质 C、碱溶液能使无色酚酞溶液变红,所以使酚酞溶液变红的溶液一定是碱溶液 D、氧化物都含有氧元素,所以含有氧元素的化合物一定是氧化物15. 有三种金属X、Y、Z,它们与酸或盐溶液可发生如下反应:
A、图 1 比较 Zn 和 Fe 的金属活动性强弱 B、图 2 探究铁钉生锈时 O2 是否参与反应 C、图 3 比较红磷和白磷的着火点 D、图 4 测定空气中 O2 的含量14. 逻辑推理是化学学习常用的思维方法,下列推理正确的是( )A、中和反应有盐和水生成,但是有盐和水生成的反应不一定是中和反应 B、单质是由同种元素组成的物质,所以由同种元素组成的物质一定是单质 C、碱溶液能使无色酚酞溶液变红,所以使酚酞溶液变红的溶液一定是碱溶液 D、氧化物都含有氧元素,所以含有氧元素的化合物一定是氧化物15. 有三种金属X、Y、Z,它们与酸或盐溶液可发生如下反应:①Y+X(NO3)2=Y(NO3)2+X②X+H2SO4=XSO4+H2↑③Z不与盐酸反应。
则该三种金属的活动性顺序为( )
A、X>Y>Z B、Z>Y>X C、Z>X>Y D、Y>x>Z16. 下列四个图象,分别对应四种操作过程,其中正确的是( )A、 向pH=2的酸溶液中不断加水
B、
向pH=2的酸溶液中不断加水
B、 向NaOH溶液中逐滴加入稀盐酸
C、
向NaOH溶液中逐滴加入稀盐酸
C、 向一定量的水中持续加入食盐(m表示食盐的质量,A%表示溶质质量分数)
D、
向一定量的水中持续加入食盐(m表示食盐的质量,A%表示溶质质量分数)
D、 等质量的锌、铁与足量的稀硫酸反应,产生氢气的质量随反应时间t的变化
等质量的锌、铁与足量的稀硫酸反应,产生氢气的质量随反应时间t的变化
二、理解与应用(34分)
-
17. 请将以下物质按要求填入空格中(填化学式):
A.二氧化硫B.消石灰C.生石灰D.碳酸氢铵
(1)、煤炭燃烧排出的尾气中,能形成酸雨的是。(2)、常用作食品干燥剂的物质是。(3)、适量的可以改良酸性土壤 。(4)、可作肥料的是。18. 金属及金属材料有很多优良的性能而被广泛应用。(1)、铁制炊具加热食物,说明铁具有的性质是。(2)、铝制品比铁制品耐用,其原因是 。(3)、钛合金因为优良的性能,被广泛应用于生物医学、航空航天等领域,钛合金的优点有(任写一条),构成金属钛的粒子是(填“分子”“原子”或“离子”)(4)、合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。①熔炼制备Mg2Cu合金时,通入氩气的目的是 。
②将11.2g的Mg2Cu合金与过量盐酸反应,生成氢气的质量为g
19. 溶解度是我们初中化学常见的概念,请回答下列问题。(1)、Ⅰ.下表是NaCl、KNO3在不同温度下的溶解度:温度/℃
0
20
40
60
80
溶解度/g
NaCl
35.7
36.0
36.6
37.3
38.4
KNO3
13.3
31.6
63.9
110
169
要比较NaCl、KNO3在水中的溶解能力,需要控制的变量是水的质量和 。
(2)、从KNO3溶液中获取其晶体适宜的方法是 。(3)、20℃时,各取NaCl、KNO3固体3.5g加入10g水中,充分溶解后达到饱和状态的是溶液。(4)、若将上述数据在坐标中绘制成NaCl、KNO3的溶解度曲线,两条曲线的交点对应的温度范围是( )A、0℃~20℃ B、20℃~40℃ C、40℃~60℃ D、60℃~80℃(5)、Ⅱ.将质量为30g的B物质加入到50g水中,充分搅拌后,剩余物质的质量随温度的关系如图所示,过程中不考虑水分蒸发,回答问题:
固体B的溶解度随温度的升高而(填“增大”或“减小”)。
(6)、t1℃时,B的溶解度是 。20. 燃料的使用为我们的生活提供了方便,回答下列问题:工人师傅使用氧炔焰进行金属切割或金属焊接,氧炔焰是乙炔(C2H2)跟氧气发生燃烧反应产生的火焰。
(1)、乙炔属于(填“有机物”或“无机物”)(2)、已知乙炔完全燃烧时生成二氧化碳和水,请写出其燃烧的化学方程式。(3)、实验室用电石(CaC2)与水反应制取乙炔,电石与水的反应比较剧烈,为了得到平稳的乙炔气流,实验时常用饱和食盐水代替水,并用(填仪器名称)控制滴加速率,使用(填“块状”或“粉末状”)电石固体。21. 氢气是一种理想的新能源,具有广阔的开发前景。铁酸锌(ZnFe2O4)可用于循环分解水制氢气,其反应可表示为:6ZnFe2O4 6ZnO+4Fe3O4+O2↑:
3ZnO+2Fe3O4+H2O 3ZnFe2O4+H2↑
(1)、ZnFe2O4中Fe的化合价为。(2)、该循环制氢中不断消耗的物质是 。(3)、氢气作为新能源,有不污染环境、热值大、原料来源丰富等优点,但目前并没有被广泛应用,你认为主要原因是 。22. 过氧化钙晶体(CaO2·8H2O)较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下: (1)、气体X是;将过氧化钙晶体与溶液分离的方法是 。(2)、反应Y(反应物为氧化钙、水、过氧化氢)需控制温度在0~5℃,可将反应容器放在冰水混合物中,反应产物是CaO2·8H2O,请写出化学方程式 , 反应的基本反应类型是。(3)、获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是 。
(1)、气体X是;将过氧化钙晶体与溶液分离的方法是 。(2)、反应Y(反应物为氧化钙、水、过氧化氢)需控制温度在0~5℃,可将反应容器放在冰水混合物中,反应产物是CaO2·8H2O,请写出化学方程式 , 反应的基本反应类型是。(3)、获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是 。三、实验探究(18分)
-
23. 某研究性学习小组欲利用下列装置进行相关气体的制取,请你分析并填空。
 (1)、写出仪器a和b的名称:a , b 。(2)、实验室制取并收集二氧化碳,应选用的装置为(填字母),若用F装置干燥二氧化碳气体,F中应加入的试剂是。(3)、实验室用高锰酸钾制取氧气,该反应的化学方程式为 , 氧气验满的方法为 。24. 某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验,向烧杯中的氢氧化钙溶液滴加一定量的稀盐酸后,发现忘记滴加指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中溶质的成分进行探究。(1)、写出该中和反应的化学方程式 。(2)、探究烧杯内溶液中溶质的成分:
(1)、写出仪器a和b的名称:a , b 。(2)、实验室制取并收集二氧化碳,应选用的装置为(填字母),若用F装置干燥二氧化碳气体,F中应加入的试剂是。(3)、实验室用高锰酸钾制取氧气,该反应的化学方程式为 , 氧气验满的方法为 。24. 某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验,向烧杯中的氢氧化钙溶液滴加一定量的稀盐酸后,发现忘记滴加指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中溶质的成分进行探究。(1)、写出该中和反应的化学方程式 。(2)、探究烧杯内溶液中溶质的成分:【作出猜想】(A)溶质可能是CaCl2与Ca(OH)2(B)可能是CaCl2(C)溶质可能是CaCl2与HCl
【查阅资料】CaCl2溶液呈中性
【实验设计】
① 取少量烧杯中的溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是排除了猜想(A),你认为排除猜想(A)的理由是 。
② 小华想用碳酸钠溶液来验证后两种猜想,请你帮他完成实验,填写以下表格:
实验步骤
预计现象
预计结论
取少量反应后的溶液于试管中,逐滴加入碳酸钠溶液
猜想(B)正确
猜想(C)正确
(3)、为确定猜想(C)正确,下列几种实验方案不合理的是 (填字母)。A、取反应后的溶液于试管中,滴加紫色石蕊试液变红色 B、取反应后的溶液于试管中,加入锌粉冒气泡 C、用洁净的玻璃棒蘸取反应后的溶液,点在pH试纸上,测溶液的pH<7 D、取反应后的溶液于试管中,加入硝酸银溶液,生成白色沉淀四、计算题(本题包括2个小题,共12分)
-
25. 现有100g溶质质量分数为20%的食盐溶液,若将溶液稀释,使溶质质量分数变为5%,应向此溶液中加水 g。26. 长久使用热水壶底部有层水垢,主要成分为CaCO3和Mg(OH)2 , 某学校化学研究小组的同学通过实验测定水垢中CaCO3的含量:将过量的稀盐酸加入到200g水垢中,把产生的CO2气体用足量的NaOH溶液吸收,同时测量3min钟内NaOH溶液增加的质量,结果如下表:
时间/s
0
30
60
90
120
150
180
质量/g
0
30
50
60
66
66
66
(1)、写出CO2被足量的NaOH溶液吸收时,发生的化学反应方程式。(2)、从表格中可以看出,200g水垢与盐酸反应生成的CO2最多是 g(3)、计算水垢中碳酸钙的质量分数,写出计算过程