广东省中山市2018-2019学年中考化学模拟考试试卷
试卷更新日期:2019-05-24 类型:中考模拟
一、选择题(本题包括14小题,每小题2分,共28分)
-
1. 下列过程中,只涉及物理变化是( )A、光合作用 B、火药爆炸 C、蚕丝织布 D、冶炼金属2. 实验室中装有氢氧化钠的试剂瓶应贴有的图标是 ( )A、
 B、
B、 C、
C、 D、
D、 3. 下列物质中,化学式与俗名不相符的是( )A、Hg—水银 B、NaHCO3—苏打 C、Ca(OH)2—消石灰 D、C2H5OH—酒精4. 对下列物质的归类正确的是( )A、稀盐酸和冰水共存物都是混合物 B、水和干冰都是单质 C、塑料和合成橡胶都是有机合成材料 D、纯碱、烧碱都属于碱5. 下列关于净化水的说法正确的是( )A、活性炭能对天然水进行杀菌消毒 B、过滤能除去天然水中的所有杂质 C、自来水厂生产出的自来水属于纯净物 D、加入明矾能使水中的一些杂质沉降6. 下列有关事故的处理方法正确的是( )A、发现屋内煤气泄漏时,立即打开排气扇 B、皮肤不慎沾到浓硫酸时,立即涂NaOH溶液 C、炒菜油锅着火时,立即用锅盖盖灭 D、高层住房着火时,立即打开所有门窗7. 下列数据为常见水果的近似pH,其中酸性最强的是( )A、杨梅pH=2.5 B、苹果pH=4.1 C、菠萝pH=5.1 D、柿子pH=8.58. 甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
3. 下列物质中,化学式与俗名不相符的是( )A、Hg—水银 B、NaHCO3—苏打 C、Ca(OH)2—消石灰 D、C2H5OH—酒精4. 对下列物质的归类正确的是( )A、稀盐酸和冰水共存物都是混合物 B、水和干冰都是单质 C、塑料和合成橡胶都是有机合成材料 D、纯碱、烧碱都属于碱5. 下列关于净化水的说法正确的是( )A、活性炭能对天然水进行杀菌消毒 B、过滤能除去天然水中的所有杂质 C、自来水厂生产出的自来水属于纯净物 D、加入明矾能使水中的一些杂质沉降6. 下列有关事故的处理方法正确的是( )A、发现屋内煤气泄漏时,立即打开排气扇 B、皮肤不慎沾到浓硫酸时,立即涂NaOH溶液 C、炒菜油锅着火时,立即用锅盖盖灭 D、高层住房着火时,立即打开所有门窗7. 下列数据为常见水果的近似pH,其中酸性最强的是( )A、杨梅pH=2.5 B、苹果pH=4.1 C、菠萝pH=5.1 D、柿子pH=8.58. 甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( ) A、20 ℃时,甲溶液一定比乙溶液浓 B、将40 ℃时甲的一定量饱和溶液降温至20 ℃,溶液质量不变 C、甲的溶解度大于乙的溶解度 D、40 ℃时,分别在100 g水中各加入30 g甲、乙,同时降温至20 ℃,甲、乙溶液均为饱和溶液9. 焦亚硫酸钠在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠(Na2S2O6)中硫元素的化合价为( )A、-2 B、+3 C、+4 D、+510. 下图所示实验操作中,错误的是( )A、称量NaOH
A、20 ℃时,甲溶液一定比乙溶液浓 B、将40 ℃时甲的一定量饱和溶液降温至20 ℃,溶液质量不变 C、甲的溶解度大于乙的溶解度 D、40 ℃时,分别在100 g水中各加入30 g甲、乙,同时降温至20 ℃,甲、乙溶液均为饱和溶液9. 焦亚硫酸钠在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠(Na2S2O6)中硫元素的化合价为( )A、-2 B、+3 C、+4 D、+510. 下图所示实验操作中,错误的是( )A、称量NaOH B、CO2性质检验
B、CO2性质检验  C、添加酒精
C、添加酒精  D、制取CO2并验满
D、制取CO2并验满  11. 归纳总结和逻辑推理是化学学习中常用的思维方法。下列归纳推理正确的是( )A、二氧化碳气体和氧气都能用浓H2SO4干燥 B、Na2CO3溶液和NaCl溶液都能使无色酚酞试液变红 C、稀有气体可作保护气,则可作保护气的一定是稀有气体 D、中和反应生成盐和水,则生成盐和水的反应一定是中和反应12. 下列知识整理的内容均正确的一组是( )
11. 归纳总结和逻辑推理是化学学习中常用的思维方法。下列归纳推理正确的是( )A、二氧化碳气体和氧气都能用浓H2SO4干燥 B、Na2CO3溶液和NaCl溶液都能使无色酚酞试液变红 C、稀有气体可作保护气,则可作保护气的一定是稀有气体 D、中和反应生成盐和水,则生成盐和水的反应一定是中和反应12. 下列知识整理的内容均正确的一组是( )A.物质的分类
B.物质的检验
冰水、雨水和蒸馏水都是混合物
消石灰、纯碱和烧碱都是碱
用灼烧的方法能区别棉花和羊毛
用酚酞试液能区分熟石灰和氢氧化钠
C.化学与生活、生产
D.“低碳经济”的措施
用甲醛溶液浸泡海产品保鲜
硫酸铵不能与草木灰(碱性物质)混合施用
减少煤、石油和天然气等化石燃料的使用
鼓励乘坐公交车出行,倡导低碳生活
A、A B、B C、C D、D13. 用括号中的试剂除去下列物质中的杂质,所用试剂错误的是( )A、除去CO2中的CO(灼热的CuO) B、除去C粉中的Cu粉(稀硫酸) C、除去NaCl溶液中的Na2CO3(CaCl2溶液) D、除去O2中的水蒸气(CaO)14. 下列图象与对应的叙述相符合的是( )A、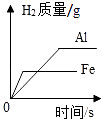 等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应
B、
等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应
B、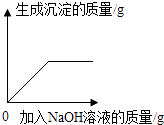 向H2SO4和MgSO4的混合溶液中滴加NaOH溶液
C、
向H2SO4和MgSO4的混合溶液中滴加NaOH溶液
C、 向pH=13的氢氧化钠溶液中不断加水稀释
D、
向pH=13的氢氧化钠溶液中不断加水稀释
D、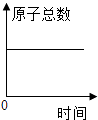 化学反应中,原子总数随时间的变化
化学反应中,原子总数随时间的变化
二、填空题(本题包括5小题,共20分)
-
15. C、O、N、H、Ca是初中常见的元素,请选用其中的元素写出符合下列要求的物质的化学式或化学符号:(1)、属于金属单质;(2)、铵态氮肥中的阳离子;(3)、能用于改良酸性土壤的物质;(4)、能作干燥剂的物质;16. 我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破。甲烷转化反应的微观示意图如下:

图示中属于单质的物质名称是;图示所表示的反应的化学方程式为 , 该反应属于基本反应类型中的反应。
17. 以下有甲、乙、丙、丁四个实验,请回答相应问题: (1)、在甲实验中,刚开始白磷不燃烧,此时用注射器向瓶内压入空气,瓶内水面下降,长颈漏斗液面上升,当白磷暴露在空气中时立即燃烧,产生大量白烟,说明可燃物燃烧的条件是。(2)、乙是简易净水装置,该装置中小卵石和石英沙的作用是。(3)、丙实验中,①②③④都是用附有紫色石蕊的棉球,①④为润湿的,②③为干燥,缓慢通入CO2后,最先变红色的是 (填编号)(4)、丁实验是探究Cu和Ag的金属活动顺序,无色溶液可能是(填编号)。
(1)、在甲实验中,刚开始白磷不燃烧,此时用注射器向瓶内压入空气,瓶内水面下降,长颈漏斗液面上升,当白磷暴露在空气中时立即燃烧,产生大量白烟,说明可燃物燃烧的条件是。(2)、乙是简易净水装置,该装置中小卵石和石英沙的作用是。(3)、丙实验中,①②③④都是用附有紫色石蕊的棉球,①④为润湿的,②③为干燥,缓慢通入CO2后,最先变红色的是 (填编号)(4)、丁实验是探究Cu和Ag的金属活动顺序,无色溶液可能是(填编号)。①稀H2SO4 ②FeSO4溶液 ③Cu(NO3)2溶液 ④AgNO3溶液
18. 随着人们生活水平的不断提高,汽车已走进千家万户。制造汽车要用到含铜、铁、铝等成分的多种金属材料。(1)、在汽车电路中,经常用铜作导线,这是利用了铜的性。(2)、铜生锈的化学方程式为2Cu+X+H2O+CO2=Cu2(OH)2CO3 , 则X的化学式为。(3)、车体多用钢材制造且要对其表面进行喷漆处理,这样不仅美观,而且可有效防止钢材与(填名称)接触而生锈。汽车使用的金属材料多为合金,是因为合金与纯金属相比,具有(填一条)等优良性能。19. 下表是KNO3和NaNO3在不同温度时的溶解度(单位:g)。温度/℃
10
20
30
40
50
60
70
80
90
100
KNO3
20.9
31.6
45.8
63.9
85.5
110
138
169
202
246
NaNO3
80
87
95
103
114
125
136
150
163
170
(1)、从表中数据看出,KNO3与NaNO3溶解度受温度影响更大的是。(2)、10℃时,100g水中最多溶解NaNO3g。(3)、60℃时,向盛100g水的烧杯中加入100gKNO3 , 配成溶液,然后降温至20℃,烧杯中析出的晶体为g。(精确到0.1)(4)、KNO3和NaNO3在t℃时的溶解度均为Wg,分析上表数据可推知,W的数值所在的最精确范围是。三、简答题(本题包括2小题,共16分)
-
20. 下列是初中化学中常见的物质:碳、铜、氧气、氧化铁、一氧化碳、二氧化碳、水。用它们进行击鼓传球游戏,条件是相互之间能发生反应就可以进行传递,最后一位将球投篮。请把上述物质分别安排在A~G的位置上,使篮球能从A传到G。其中A在常温下是液体,固体B的俗称为干冰。

请回答:
(1)、A的化学式为;碳应放在位置上。(2)、B和C反应的化学方程式为 , 反应类型为反应。(3)、写出A~G传递过程中置换反应的化学方程式:。21. 某校兴趣小组欲利用ZnCO3和Cu2O的混合物制备硫酸锌和金属铜。该小组设计了如下图的实验方案,回答下列有关问题:
(查阅资料:Cu2O是红色固体,它与稀硫酸的反应为:Cu2O+H2SO4=CuSO4+Cu+H2O)
(1)、图中X的化学式为 , A中的物质有。(2)、加入过量的Y有两个作用:一是 , 二是。写出其中1个反应的化学方程式。
(3)、操作Ⅰ、Ⅱ用到的玻璃仪器有烧杯、漏斗和 , 该仪器在操作Ⅱ中起到的作用是。(4)、操作Ⅲ包含蒸发浓缩、、过滤。四、实验题(本题包括2小题,共22分)
-
22. 现有如下仪器或装置,请回答下列问题:
 (1)、仪器a的名称为。(2)、用高锰酸钾制取氧气的化学方程式为 ,
(1)、仪器a的名称为。(2)、用高锰酸钾制取氧气的化学方程式为 ,选用装置D来进行制取时,通常要在试管口处放上。
(3)、草酸(H2C2O4)固体在浓硫酸作用下发生反应:H2C2O4 CO2↑+CO↑+H2O,若用该反应来制取CO,制气装置应选(填字母)和C进行组合;除去其中的CO2可选仪器A和C进行组合,C中最好装入下列试剂中的(填小写字母)。
a.烧碱溶液 b.浓硫酸 c.澄清石灰水
(4)、若用CO还原氧化铜粉末,应选装置 , 反应的化学方程式为。(5)、图2为某种“微型”实验装置。如果G处装稀盐酸,H处放少量铁屑,挤出少量盐酸使反应发生一段时间后,加热处出现的现象是。“微型塑料滴管”的功能相当于图1中的(填字母)。用微型仪器进行实验的优点很多,除试剂用量极少以外,还有(答一条)等等。23. 学完酸碱盐知识后,小美对妈妈焙制糕点用的小苏打很感兴趣,她把小苏打带到实验室与小刚一起进行探究。(1)、小美取少量小苏打溶于水,滴加酚酞试液后,变红,说明小苏打的水溶液显性;(2)、小刚在烧杯内放入少量小苏打,向其中滴加稀盐酸,立即有产生,说明小苏打能与酸反应。在医疗上可以用小苏打治疗;(3)、小美想:糕点非常松软,是不是小苏打受热分解产生了CO2气体呢?于是她用下图装置对小苏打进行加热,一段时间后,导管口的确有气泡冒出,澄清石灰水变浑浊,同时试管口有水珠生成。
当导管口不再有气泡产生时,试管内仍有白色固体,她猜测
剩余固体可能是:

①NaOH; ②Na2CO3; ③NaCl。
小刚认为猜想一定不正确,理由是。
小刚从试管内取少量白色固体溶于水,滴加酚酞,溶液变红,他判断该固体为NaOH,小美认为他的实验设计不合理,因为
(4)、操作步骤
实验现象
结论
取少量白色固体于试管中,加水溶解,向其中滴加溶液
产生白色沉淀
试管内剩余的固体为Na2CO3
小美和小刚继续探究固体成分,设计了如下实验:
通过实验证明小苏打受热会分解,反应的化学方程式为:。通过本次探究学习,小美对小苏打的性质有了全面的认识:她给妈妈提出保存小苏打的建议有: (答出一点即可)。
五、计算题(本题包括2小题,共14分)
-
24. 蔗糖的化学式C12H22O11 , 是食品中常用的甜品剂.请回答下列问题:(1)、蔗糖中H、O三种元素的原子个数比为:;蔗糖的相对分子质量是。(2)、蔗糖中碳元素的质量分数为:。(3)、要配制20%的蔗糖溶液80g,需要蔗糖的质量为:。(4)、要把(3)配得的溶液稀释为10%,需要添加水的质量为:。25. 某化学兴趣小组为测定大理石中碳酸钙的含量,进行如下图所示实验:

将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
时间/分
0
2
4
6
8
10
12
C增加质量/g
0
3.0
5.0
6.0
6.6
x
6.6
(1)、上表中,第10分钟时,x =。(2)、计算大理石样品中碳酸钙的质量分数。(要写计算过程)(3)、请在下图的坐标纸上,以时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线。 (4)、B中所装药品为碳酸氢钠溶液,作用是吸收挥发出的HCl气体,该装置使测量结果(填“偏大”“偏小”或“没有影响”)。
(4)、B中所装药品为碳酸氢钠溶液,作用是吸收挥发出的HCl气体,该装置使测量结果(填“偏大”“偏小”或“没有影响”)。