2019年初中化学常见题型知识点专练 26 流程图
试卷更新日期:2019-05-22 类型:二轮复习
一、综合题
-
1. 粗盐中含有Mg 、Ca 等杂质,工业提纯粗盐的工艺流程如图所示
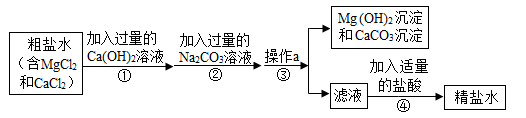 (1)、Ca(OH)2溶液的pH(填“>”、“=”或“<”)(2)、步骤①反应的化学方程式为;(3)、步骤④加入适量盐酸的目的是除去滤液中的;(4)、若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有.2. 下面是制备高纯氧化锌的流程图,根据流程图回答下列问题:
(1)、Ca(OH)2溶液的pH(填“>”、“=”或“<”)(2)、步骤①反应的化学方程式为;(3)、步骤④加入适量盐酸的目的是除去滤液中的;(4)、若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有.2. 下面是制备高纯氧化锌的流程图,根据流程图回答下列问题: (1)、反应①的基本反应类型是;(2)、写出反应②的化学方程式;(3)、过滤得到的NH4Cl溶液仍有浑浊,原因可能是(写出一种即可);(4)、草酸锌受热分解的化学方程式为:ZnC2O4 ZnO+CO↑+CO2↑,从环保角度看,反应后的气体,排放前的处理方法是。3. 如图为某化工企业生产流程示意图:
(1)、反应①的基本反应类型是;(2)、写出反应②的化学方程式;(3)、过滤得到的NH4Cl溶液仍有浑浊,原因可能是(写出一种即可);(4)、草酸锌受热分解的化学方程式为:ZnC2O4 ZnO+CO↑+CO2↑,从环保角度看,反应后的气体,排放前的处理方法是。3. 如图为某化工企业生产流程示意图: (1)、钛酸亚铁(FeTiO3)中钛元素为价;(2)、①中反应为:2FeTiO3+6C+7Cl2 2X+2TiCl4+6CO,则X为;(3)、③中氩气(Ar)作保护气,发生的置换反应是;(4)、②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为 .4. 城镇自来水厂生产流程可用下图表示:
(1)、钛酸亚铁(FeTiO3)中钛元素为价;(2)、①中反应为:2FeTiO3+6C+7Cl2 2X+2TiCl4+6CO,则X为;(3)、③中氩气(Ar)作保护气,发生的置换反应是;(4)、②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为 .4. 城镇自来水厂生产流程可用下图表示: (1)、①用的絮凝剂如明矾在净水中的作用;②上图中除去水中固态杂质的设备是 , 实验室做这个实验需用到的玻璃仪器有、、;③投药(多为ClO2)的作用是 , 其中Cl的化合价为。
(1)、①用的絮凝剂如明矾在净水中的作用;②上图中除去水中固态杂质的设备是 , 实验室做这个实验需用到的玻璃仪器有、、;③投药(多为ClO2)的作用是 , 其中Cl的化合价为。
(2)、自然界的水多含有杂质。含有较多可溶性钙、镁化合物的水通常称为硬水,实验室常用鉴别硬水与软水,生活中软化硬水的简易办法是。5. 有一工业流程如下图所示: (1)、请将电石与水反应的化学方程式补充完整:
(1)、请将电石与水反应的化学方程式补充完整:CaC2+2H2O=Ca(OH)2+↑;
(2)、有关物质常温下的溶解度如下表:物质
Ca(ClO3)2
CaCl2
KClO3
KCl
溶解度/g
209.0
74.5
7.3
34.2
上述流程中加入了KCl粉末,KCl与(填化学式)发生了复分解反应得到KClO3晶体,该过程得到KClO3晶体的原因是。
6. 人们曾用贝壳(主要成分是碳酸钙,杂质不参与反应且不溶于水)和纯碱为原材料制取烧碱,制取流程如下图所示。 (1)、写出步骤①、②的化学方程式①;②。(2)、固体A的成分可能是纯净的氢氧化钠,还可能是、(填化学式)。7. 现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
(1)、写出步骤①、②的化学方程式①;②。(2)、固体A的成分可能是纯净的氢氧化钠,还可能是、(填化学式)。7. 现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
回答问题:
(1)、反应③的化学方程式为。该反应的基本类型属于反应。(2)、反应②的化学方程式为。(3)、整个生产过程中可循环利用的物质是(填化学式)。8. 某科研小组对废弃辉铜矿(主要含有 Cu2S、ZnO 及一些不溶性杂质)进行物质提纯以实现废物综合利用。部分实验流程如下:
请根据上述实验流程回答下列问题:
(1)、“焙烧”(加热而又不使熔化)中生成CuO和SO2 , 该气体直接排放会使雨水pH小于 , 形成酸雨。(2)、“酸浸”时发生的反应类型是。(3)、“置换”时反应的方程式为(写出一个即可)。滤渣2的成分为(填化学式)。(4)、“氧化”时高锰酸钾溶液和双氧水(过氧化氢溶液)都能将Fe2+氧化为Fe3+ , 从绿色化学角度考虑物质A选用较合适。(5)、聚合硫酸铁常用于净水,其化学式可表示为[Fea(OH)b(SO4)c]n。实验测得某聚合硫酸铁中铁离子与硫酸根离子的质量比为7∶15,则b∶a =。9. 为测定某硫酸铜样品中硫酸铜的含量(杂质不溶于水,不含铜元素,不与其他物质发生反应),进行了如下实验 (1)、上述实验过程中发生反应的化学方程式为。(2)、根据已知条件列出求解C烧杯中参加反应的硫酸铜质量(X)的比例式。(3)、配制上述实验所用的氢氧化钾溶液,需要质量分数为20%的氢氧化钾溶液的质量为。(4)、样品中硫酸铜的质量分数为。(5)、D烧杯溶液中溶质的质量分数为。(6)、若用湿法冶金的方法冶炼出100kg含杂质4%的铜,需要这种硫酸铜的质量为。10. 黄铜是Zn以主要添加元素的铜合金。黄铜渣中约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水,不参与反应):
(1)、上述实验过程中发生反应的化学方程式为。(2)、根据已知条件列出求解C烧杯中参加反应的硫酸铜质量(X)的比例式。(3)、配制上述实验所用的氢氧化钾溶液,需要质量分数为20%的氢氧化钾溶液的质量为。(4)、样品中硫酸铜的质量分数为。(5)、D烧杯溶液中溶质的质量分数为。(6)、若用湿法冶金的方法冶炼出100kg含杂质4%的铜,需要这种硫酸铜的质量为。10. 黄铜是Zn以主要添加元素的铜合金。黄铜渣中约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水,不参与反应): (1)、步骤Ⅰ中产生气体的化学反应方程式为 , 属于反应(填写基本类型)。(2)、溶液A中的金属阳离子有(填化学式)。(3)、步骤Ⅰ、Ⅱ中均包含的操作名称为 , 此操作和步骤Ⅲ中的蒸发操作都要用到的玻璃仪器是。(4)、溶液A的质量(填“大于”、“小于”或“等于”)溶液C的质量。原因是。11. 工业上用铝土矿(含有Al2O3和SiO2 , 不考虑其它杂质)制取金属铝的基本流程如图所示:
(1)、步骤Ⅰ中产生气体的化学反应方程式为 , 属于反应(填写基本类型)。(2)、溶液A中的金属阳离子有(填化学式)。(3)、步骤Ⅰ、Ⅱ中均包含的操作名称为 , 此操作和步骤Ⅲ中的蒸发操作都要用到的玻璃仪器是。(4)、溶液A的质量(填“大于”、“小于”或“等于”)溶液C的质量。原因是。11. 工业上用铝土矿(含有Al2O3和SiO2 , 不考虑其它杂质)制取金属铝的基本流程如图所示: (1)、通过该流程可得出SiO2的性质有______(填序号)。A、难溶于水 B、不能与稀硫酸反应 C、能与氢氧化钠溶液反应(2)、铝土矿中氧化铝与稀硫酸反应生成硫酸铝和水的化学方程式为。(3)、操作1的名称为。(4)、铝合金材料具有较好的抗腐蚀性,这是因为。12. 海水是巨大的资源宝库。如下图所示,实验室以海水为原料获得许多化工产品:
(1)、通过该流程可得出SiO2的性质有______(填序号)。A、难溶于水 B、不能与稀硫酸反应 C、能与氢氧化钠溶液反应(2)、铝土矿中氧化铝与稀硫酸反应生成硫酸铝和水的化学方程式为。(3)、操作1的名称为。(4)、铝合金材料具有较好的抗腐蚀性,这是因为。12. 海水是巨大的资源宝库。如下图所示,实验室以海水为原料获得许多化工产品: (1)、完成步骤①,过滤之前的操作是(填操作名称);(2)、整个实验中可以循环使用的物质是(填名称);(3)、步骤②发生的是置换反应,试写出该反应的化学方程式:。(4)、粗盐中除了NaCl之外,还含有MgCl2和CaCl2等杂质,要最终得到纯净的NaCl,应该选用的一组药品是_____________________________(填序号)。A、过量KOH溶液、过量K2CO3溶液、适量稀盐酸 B、过量Na2CO3溶液、过量NaNO3溶液、过量稀硫酸 C、过量NaOH溶液、过量Na2CO3溶液、过量稀盐酸 D、过量NaOH溶液、过量Na2CO3溶液、适量稀硫酸
(1)、完成步骤①,过滤之前的操作是(填操作名称);(2)、整个实验中可以循环使用的物质是(填名称);(3)、步骤②发生的是置换反应,试写出该反应的化学方程式:。(4)、粗盐中除了NaCl之外,还含有MgCl2和CaCl2等杂质,要最终得到纯净的NaCl,应该选用的一组药品是_____________________________(填序号)。A、过量KOH溶液、过量K2CO3溶液、适量稀盐酸 B、过量Na2CO3溶液、过量NaNO3溶液、过量稀硫酸 C、过量NaOH溶液、过量Na2CO3溶液、过量稀盐酸 D、过量NaOH溶液、过量Na2CO3溶液、适量稀硫酸