广西北部湾经济区六市2018-2019学年中考化学模拟考试试卷
试卷更新日期:2019-05-20 类型:中考模拟
一、选择题(本大题有20小题,每小题2分,共40分。)
-
1. 下列变化属于物理变化的是( )A、纸张燃烧 B、食物腐烂 C、石蜡熔化 D、钢铁生锈2. 下列气体能供给呼吸的是( )A、氧气 B、氮气 C、二氧化碳 D、稀有气体3. 人体缺碘易引发的疾病是( )A、贫血 B、夜盲症 C、骨质疏松 D、甲状腺肿大4. 下列物质属于纯净物的是( )A、碘酒 B、牛奶 C、矿泉水 D、二氧化硫5. 用分子的观点分析“湿衣服晾干”的原因,合理的是( )A、水分子分解 B、水分子的体积变小 C、水分子不断运动 D、水分子之间有间隔6. 下列实验基本操作,正确的是( )A、取用药品
 B、滴加液体
B、滴加液体  C、加热固体药品
C、加热固体药品  D、量取9.5mL液体
D、量取9.5mL液体  7. 下列化学肥料,属于复合肥的是( )A、NH4H2PO4 B、CO(NH2)2 C、NH4Cl D、K2SO48. 下列做法错误的是( )A、炒菜时油锅着火用锅盖盖灭 B、用洗洁精清洗餐具上的油污 C、霉变大米经清洗后仍蒸煮食用 D、回收废弃塑料,减少“白色污染”9. 下列有关水的说法,错误的是( )A、水是常用的溶剂 B、工业废水经处理达标后才可排放 C、生活中常用煮沸的方法降低水的硬度 D、净水过程中活性炭起吸附和消毒作用10. 下列有关氧气的说法,正确的是( )A、氧气可以用作燃料 B、物质与氧气的反应都属于化合反应 C、实验室可以用向上排空气法收集氧气 D、氧气的化学性质比较活泼,可以跟任何物质发生反应11. 下列物质对应的用途,错误的是( )A、大理石——用作建筑材料 B、干冰——用于人工降雨 C、小苏打——用于焙制糕点 D、烧碱——用于治疗胃酸过多12. 下列对催化剂的认识,正确的是( )A、化学反应后催化剂的质量增加 B、催化剂可以改变化学反应速率 C、化学反应后催化剂的化学性质改变 D、加入催化剂可以使生成物的质量增加13. 下列说法正确的是( )A、凡是均一的、稳定的液体一定是溶液 B、NH4NO3固体溶于水时溶液的温度降低 C、浓盐酸敞口放置一段时间后,溶液的质量增加 D、浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液14. 高锰酸钾和浓盐酸发生如下反应:2KMnO4+16HCl=2KCl+2X+5Cl2↑+8H2O,则X的化学式是( )A、MnCl2 B、MnO2 C、ClO2 D、HClO15. 下列涉及学科观点的说法,错误的是( )A、微粒观:水是由氢原子和氧原子构成的 B、安全观:稀释浓硫酸时切不可将水倒入浓硫酸中 C、转化观:一氧化碳和二氧化碳在一定条件下可以相互转化 D、结构观:因为碳原子的排列方式不同,所以金刚石和石墨的物理性质不同16. 对下列图示信息分析,错误的是( )
7. 下列化学肥料,属于复合肥的是( )A、NH4H2PO4 B、CO(NH2)2 C、NH4Cl D、K2SO48. 下列做法错误的是( )A、炒菜时油锅着火用锅盖盖灭 B、用洗洁精清洗餐具上的油污 C、霉变大米经清洗后仍蒸煮食用 D、回收废弃塑料,减少“白色污染”9. 下列有关水的说法,错误的是( )A、水是常用的溶剂 B、工业废水经处理达标后才可排放 C、生活中常用煮沸的方法降低水的硬度 D、净水过程中活性炭起吸附和消毒作用10. 下列有关氧气的说法,正确的是( )A、氧气可以用作燃料 B、物质与氧气的反应都属于化合反应 C、实验室可以用向上排空气法收集氧气 D、氧气的化学性质比较活泼,可以跟任何物质发生反应11. 下列物质对应的用途,错误的是( )A、大理石——用作建筑材料 B、干冰——用于人工降雨 C、小苏打——用于焙制糕点 D、烧碱——用于治疗胃酸过多12. 下列对催化剂的认识,正确的是( )A、化学反应后催化剂的质量增加 B、催化剂可以改变化学反应速率 C、化学反应后催化剂的化学性质改变 D、加入催化剂可以使生成物的质量增加13. 下列说法正确的是( )A、凡是均一的、稳定的液体一定是溶液 B、NH4NO3固体溶于水时溶液的温度降低 C、浓盐酸敞口放置一段时间后,溶液的质量增加 D、浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液14. 高锰酸钾和浓盐酸发生如下反应:2KMnO4+16HCl=2KCl+2X+5Cl2↑+8H2O,则X的化学式是( )A、MnCl2 B、MnO2 C、ClO2 D、HClO15. 下列涉及学科观点的说法,错误的是( )A、微粒观:水是由氢原子和氧原子构成的 B、安全观:稀释浓硫酸时切不可将水倒入浓硫酸中 C、转化观:一氧化碳和二氧化碳在一定条件下可以相互转化 D、结构观:因为碳原子的排列方式不同,所以金刚石和石墨的物理性质不同16. 对下列图示信息分析,错误的是( ) A、④的粒子符号为Na+ B、②与⑤的化学性质相似 C、溴的相对原子质量是79.90 D、图中所有元素都属于非金属元素17. 推理是学习化学常用的一种方法,以下推理正确的是( )A、置换反应有单质生成,所以有单质生成的反应一定是置换反应 B、质子数决定元素种类,所以质子数相同的原子一定属于同种元素 C、CO2、SO2均可与碱溶液反应,所以非金属氧化物一定能与碱溶液反应 D、可燃物燃烧时温度需要达到着火点,所以温度达到着火点时,可燃物就一定能燃烧18. 下列各组离子能在pH=2的无色溶液中大量共存的是( )A、K+、Na+、NO 、SO B、K+、Mg2+、OH-、CO C、Ba2+、Na+、HCO 、SO D、NH 、Cu2+、Cl-、NO19. 除去下列各组物质中的杂质,所用试剂和操作方法均正确的是( )
A、④的粒子符号为Na+ B、②与⑤的化学性质相似 C、溴的相对原子质量是79.90 D、图中所有元素都属于非金属元素17. 推理是学习化学常用的一种方法,以下推理正确的是( )A、置换反应有单质生成,所以有单质生成的反应一定是置换反应 B、质子数决定元素种类,所以质子数相同的原子一定属于同种元素 C、CO2、SO2均可与碱溶液反应,所以非金属氧化物一定能与碱溶液反应 D、可燃物燃烧时温度需要达到着火点,所以温度达到着火点时,可燃物就一定能燃烧18. 下列各组离子能在pH=2的无色溶液中大量共存的是( )A、K+、Na+、NO 、SO B、K+、Mg2+、OH-、CO C、Ba2+、Na+、HCO 、SO D、NH 、Cu2+、Cl-、NO19. 除去下列各组物质中的杂质,所用试剂和操作方法均正确的是( )选项
物质(括号内为杂质)
除杂试剂
操作方法
A
NaCl(Na2SO4)
过量BaCl2溶液
过滤
B
K2CO3(KCl)
足量稀盐酸
蒸发结晶
C
N2(CO)
CuO
通过灼热的CuO
D
KNO3(NaCl)
水
加热溶解、降温结晶
A、A B、B C、C D、D20. 向装有过量锌粉的烧杯中加入一定质量AgNO3和Cu(NO3)2的混合溶液,烧杯中固体的质量随反应时间变化的情况如图所示。下列说法正确的是( ) A、t<t2时,若向溶液中滴加NaCl溶液,无明显变化的 B、t1时,溶液中金属离子有3种,固体中金属单质有2种 C、t3和t5时,溶液中的溶质种类不同,金属单质种类也不同 D、t1<t<t2时,若向溶液中插入铝丝,铝丝表面有红色固体析出
A、t<t2时,若向溶液中滴加NaCl溶液,无明显变化的 B、t1时,溶液中金属离子有3种,固体中金属单质有2种 C、t3和t5时,溶液中的溶质种类不同,金属单质种类也不同 D、t1<t<t2时,若向溶液中插入铝丝,铝丝表面有红色固体析出二、填空题(本大题有5小题,每个化学方程式2分,其余每空1分,共26分)
-
21. 请按要求写出化学符号或符号中数字的意义。(1)、2个硫原子(2)、3个氢分子(3)、人体中含量最多的金属元素(4)、五氧化二磷中磷元素的化合价(5)、NH3中数字“3”表示22. 厉害了我的国!厉害了我的大广西!根据《广西铁路建设“十三五”规划》,2020年全区将基本实现“市市通高铁”,方便人们的出行。
 (1)、高铁列车利用碳滑板与接触网接触来获取电能。碳滑板通常用石墨制成,这利用了石墨的性。(2)、制造高铁列车的材料有:塑料、铝合金、不锈钢等。其中塑料属于(选填“金属材料”或“合成材料”);所需钢材通常以赤铁矿(主要成分Fe2O3)为原料炼制,请写出该炼铁原理: (用化学方程式表示)。(3)、高铁列车的餐车上为乘客准备的午餐为:大米饭、煎鸡蛋、炒牛肉、大白菜。这份午餐中大米饭提供的主要营养素是。23. 宏观辨识与微观探析是化学学科核心素养之一,将宏微结合有助于化学的学习。(1)、下图是某物质发生化学变化过程的微观示意图。
(1)、高铁列车利用碳滑板与接触网接触来获取电能。碳滑板通常用石墨制成,这利用了石墨的性。(2)、制造高铁列车的材料有:塑料、铝合金、不锈钢等。其中塑料属于(选填“金属材料”或“合成材料”);所需钢材通常以赤铁矿(主要成分Fe2O3)为原料炼制,请写出该炼铁原理: (用化学方程式表示)。(3)、高铁列车的餐车上为乘客准备的午餐为:大米饭、煎鸡蛋、炒牛肉、大白菜。这份午餐中大米饭提供的主要营养素是。23. 宏观辨识与微观探析是化学学科核心素养之一,将宏微结合有助于化学的学习。(1)、下图是某物质发生化学变化过程的微观示意图。
①结合上图分析,化学变化中的最小粒子是(选填“分子”、“原子”或“离子”,下同),丙图中所示物质都是由 构成的。
②该反应的化学方程式是 。
(2)、“物质的量”是将微观粒子数目与宏观物质的质量联系起来的物理量,其单位是摩尔。1摩尔任何物质中含有构成该物质的粒子个数约为6.02×1023个。1摩尔任何物质的质量以克为单位时,数值上都等于该物质的相对分子质量。例如1摩尔H2O的质量是18g,约含有6.02×1023个水分子。1摩尔CO2中约含有个二氧化碳分子,2摩尔O2的质量为g。24. 甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如右下图所示,请回答: (1)、t2℃时,甲物质的溶解度是g。(2)、t1℃时,三种物质的溶解度由大到小的排列顺序是。(3)、P点对应的乙物质溶液是(填“饱和”或“不饱和”)溶液。(4)、在压强为101KPa时,氧气的溶解度随温度变化的趋势与图中物质相似。(5)、t2℃时,等质量的甲、乙、丙三种物质的饱和溶液中溶剂质量最小的是。25. 已知A-G是初中化学常见的七种物质,其中C常用于改良酸性土壤。下图是根据物质的类别和物质中某一种元素的化合价构建的转化关系图(图中“→”表示一种物质转化成另一种物质)。请回答下列问题:
(1)、t2℃时,甲物质的溶解度是g。(2)、t1℃时,三种物质的溶解度由大到小的排列顺序是。(3)、P点对应的乙物质溶液是(填“饱和”或“不饱和”)溶液。(4)、在压强为101KPa时,氧气的溶解度随温度变化的趋势与图中物质相似。(5)、t2℃时,等质量的甲、乙、丙三种物质的饱和溶液中溶剂质量最小的是。25. 已知A-G是初中化学常见的七种物质,其中C常用于改良酸性土壤。下图是根据物质的类别和物质中某一种元素的化合价构建的转化关系图(图中“→”表示一种物质转化成另一种物质)。请回答下列问题: (1)、B的化学式是 , C的俗名是 。(2)、A、F均可与G溶液反应,分别生成含同种金属元素的两种盐溶液。F与G反应的化学方程式为。(3)、若E是由三种元素组成的钠盐。在C溶液中加入一定量E溶液,充分反应后过滤,向滤液中滴入过量G溶液,无明显现象,则该滤液中的溶质是(写出所有可能情况)
(1)、B的化学式是 , C的俗名是 。(2)、A、F均可与G溶液反应,分别生成含同种金属元素的两种盐溶液。F与G反应的化学方程式为。(3)、若E是由三种元素组成的钠盐。在C溶液中加入一定量E溶液,充分反应后过滤,向滤液中滴入过量G溶液,无明显现象,则该滤液中的溶质是(写出所有可能情况)三、简答题(本大题有2小题,每个化学方程式2分,其余每空1分,共12分)
-
26. 人们使用过的家用燃料有柴草、煤、液化石油气、天然气等。(1)、天然气的主要成分是(填化学式)。(2)、煤属于(选填“可再生”或“不可再生”能源。燃煤常加工成“蜂窝状”,是为了 。(3)、家用燃料都含有碳元素,燃烧不充分易产生气体,与血液中的血红蛋白结合而导致人体中毒,所以使用家用燃料时要注意 。(4)、目前,人们利用和开发的能源除水能、风能、核能外,还有(列举一种)。27. 用铝土矿(主要含SiO2、Al2O3和少量Fe2O3等)制取铝硅合金材料有干法、湿法等方法,其中干法制备的工艺流程如下图所示。
(已知:Ⅰ.SiO2不溶于水、不与硫酸反应。Ⅱ.转化率是反应物转化为生成物的百分率。)
 (1)、铝硅合金的硬度比纯铝的硬度 。(2)、步骤①中焙烧除铁的反应为4(NH4)2SO4+Fe2O3 2NH4Fe(SO4)2+3H2O+6NH3↑
(1)、铝硅合金的硬度比纯铝的硬度 。(2)、步骤①中焙烧除铁的反应为4(NH4)2SO4+Fe2O3 2NH4Fe(SO4)2+3H2O+6NH3↑(Al2O3部分发生类似反应,SiO2不发生类似反应)。已知Fe2O3、Al2O3转化为硫酸盐的转化率与温度的关系如图所示,则焙烧除铁最适宜的温度为℃。
 (3)、步骤②中包括加水溶解、、洗涤等操作。(4)、步骤③中利用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。写出高温下Al4C3与Al2O3反应生成Al和CO的化学方程式:。(5)、若用湿法处理铝土矿,加过量的硫酸浸取,所得溶液中的阳离子有。
(3)、步骤②中包括加水溶解、、洗涤等操作。(4)、步骤③中利用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。写出高温下Al4C3与Al2O3反应生成Al和CO的化学方程式:。(5)、若用湿法处理铝土矿,加过量的硫酸浸取,所得溶液中的阳离子有。四、实验探究题(本大题有2小题,每个化学方程式2分,其余每空1分,共16分)
-
28. 根据下列装置图回答问题。
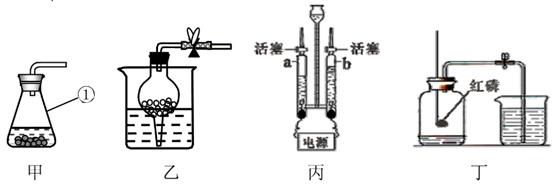 (1)、装置甲中仪器①的名称是。实验室用装置甲制取二氧化碳的化学方程式为 。装置乙也可用于实验室制取二氧化碳,与装置甲相比,装置乙的优点是。(2)、用装置丙电解水时,a管连接电源的极,a、b两管中气体的体积比约为。(3)、用装置丁测定空气中氧气的含量,红磷燃烧时的现象为 , 该实验还可说明氮气具有的化学性质是。29. 某化学兴趣小组的同学在实验室发现一瓶敞口放置的过氧化钠(Na2O2)固体,他们对该固体是否变质产生了兴趣,对固体成分进行了实验探究。
(1)、装置甲中仪器①的名称是。实验室用装置甲制取二氧化碳的化学方程式为 。装置乙也可用于实验室制取二氧化碳,与装置甲相比,装置乙的优点是。(2)、用装置丙电解水时,a管连接电源的极,a、b两管中气体的体积比约为。(3)、用装置丁测定空气中氧气的含量,红磷燃烧时的现象为 , 该实验还可说明氮气具有的化学性质是。29. 某化学兴趣小组的同学在实验室发现一瓶敞口放置的过氧化钠(Na2O2)固体,他们对该固体是否变质产生了兴趣,对固体成分进行了实验探究。【查阅资料】
① 在标准状况下,氧气的密度是1.429g/L。在室温下,1L水中能溶解约30mL的氧气。
② 过氧化钠能与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2
③ 过氧化钠能与水反应:2Na2O2+2H2O=4NaOH+O2↑
④BaCl2溶液呈中性。
【成分猜想】固体中可能有Na2O2、NaOH和Na2CO3中的一种或几种。
(1)、【实验验证】实验步骤
实验现象
结论或化学方程式
①取少量样品于试管中,加水溶解, 并立即将带火星的木条伸入试管中。
有气泡产生,
证明固体中含有Na2O2。
②取步骤①所得溶液于试管中,滴加过量的BaCl2溶液。
有白色沉淀生成。
证明固体中含有Na2CO3 ,
化学方程式为
③取步骤②中的上层清液于试管中,滴入1~2滴酚酞试液。
溶液变红
证明固体中含有NaOH。
(2)、【分析交流】经过讨论分析,同学们认为步骤③中的结论不合理,不能证明固体中含有NaOH,理由是 。(3)、【继续探究】为确定固体中是否含有NaOH,取一定质量的样品,利用下图装置进行实验验证。(BaCl2溶液的体积和温度变化对气体体积的影响忽略不计)
①装置乙中植物油的作用是 。
②待反应完全后,根据收集所得气体的体积,进行相关计算,得出样品中 的质量。
③再将烧瓶中的沉淀进行过滤、洗涤、烘干、称量,进行相关计算,得出样品中的质量。
(4)、【实验结论】经过实验数据分析,得出固体中不但含有Na2O2和Na2CO3 , 还含有NaOH。证明含有NaOH的依据是 。五、计算题
-
30. 同学们为了测定某氯化镁溶液的溶质质量分数,取100.0g氢氧化钠溶液于烧杯中,将200.0g该氯化镁溶液平均分成四次加入,充分反应后进行测量,所得数据如下图所示。
 (1)、恰好完全反应时,生成沉淀的质量为g。(2)、该氯化镁溶液的溶质质量分数。
(1)、恰好完全反应时,生成沉淀的质量为g。(2)、该氯化镁溶液的溶质质量分数。